산화수 구하는 규칙(rule)
rules for assigning oxidation numbers
---------------------------------------------------
▶ 참고: 산화-환원 반응과 산화수
[ https://ywpop.tistory.com/6525 ]
---------------------------------------------------
A. 원소에서
1. 원소의 산화수 = 0
( 원소에서 각 원자의 산화수는, 정의상, 약속에 의해, 0 )
( 참고: 원소와 화합물 https://ywpop.tistory.com/2984 )
예) H2 분자에서, H의 산화수 = 0.
예) O2(산소), O3(오존)에서, O의 산화수 = 0.
예) 마그네슘 금속, Mg(s)에서, Mg의 산화수 = 0.


2. 단원자 이온의 산화수 = 이온 전하
( 참고: 단원자 이온 https://ywpop.tistory.com/22146 )
예) K^+ 이온에서, K의 산화수 = +1.
예) Ca^2+ 이온에서, Ca의 산화수 = +2.
예) Al^3+ 이온에서, Al의 산화수 = +3.
예) F^– 이온에서, F의 산화수 = –1.
예) S^2– 이온에서, S의 산화수 = –2.


B. 화합물에서
3a. (넘버 1) 지존 원자의 절대 산화수. 넘버 1의 절대 산화수
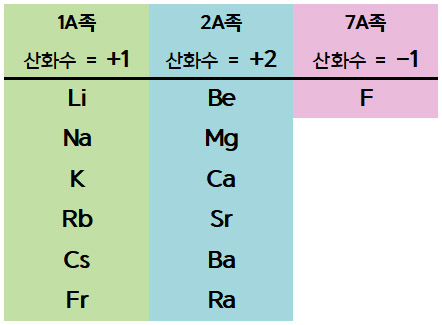
▶ 알칼리 금속(1A족)의 산화수 = +1
▶ 알칼리 토금속(2A족)의 산화수 = +2
▶ 할로겐족 원소인 F의 산화수 = –1
⇨ 화합물 또는 다원자 이온에서, 이들 지존 원자는
그 어떤 원자보다 우선적으로 각자의 산화수 값을 갖는다.
예) OF2에서, F의 산화수 = –1. ( 따라서 O의 산화수 = +2. )
예) Ca3(PO4)2에서, Ca의 산화수 = +2.
( 다음으로 O의 산화수 = –2. 따라서 P의 산화수 = +5. )
( 원자단이 있는 이온결합 화합물의 산화수 구하기 https://ywpop.tistory.com/2988 )
[참고] Al(알루미늄)의 산화수 = +3
3A족 금속인 Al은 넘버 1처럼,
화합물에서, 항상 +3의 산화수를 가진다.
3b. (넘버 2) H의 산화수 = +1
> 단, 금속 화합물(NaH)에서는 –1. ( 참고 https://ywpop.tistory.com/9233 )
> 일부 붕소 화합물에서도 –1. ( 참고 https://ywpop.tistory.com/7962 )
3c. (넘버 3) O의 산화수 = –2
> 단, 과산화물(H2O2)에서는 –1. ( H가 O보다 우선순위. )
> OF2 (oxygen fluoride) 에서, O의 산화수 = +2.
> O2F2 (dioxygen difluoride) 에서, O의 산화수 = +1.
( F가 넘버 1이므로, 우선적으로 F의 산화수 = –1. )
( 참고: 산소의 산화수 https://ywpop.tistory.com/7965 )
※ 넘버 2인 H, 넘버 3인 O는 NaH, H2O2 에서처럼,
자신보다 우선순위에 있는 원자와
단 두 종류끼리만 있을 경우에 한해, 산화수가 변한다.
4. 중성 분자에서 각 원자의 산화수의 합 = 0
예) SO2에서, O는 2×(–2)이므로, S의 산화수 = +4.
(S) + 2(O) = 0
(S) + 2(–2) = 0
5. 다원자 이온에서 각 원자의 산화수의 합 = 이온 전하
예) SO4^2–에서, O는 4×(–2), 이온 전하는 –2이므로, S의 산화수 = +6.
(S) + 4(O) = –2
(S) + 4(–2) = –2
[참고] 산화수를 결정할 때 금속, 플루오린 그리고 수소, 산소 순으로
이들의 산화수를 먼저 지정해주는 이유는 전기음성도 때문이다.
플루오린의 전기음성도가 가장 크기 때문에 –1로 우선 지정해주고,
금속의 전기음성도가 가장 작은 편이라 +1, +2로 우선 지정해주는 것이다.
( 참고: 전기음성도 https://ywpop.tistory.com/2567 )
[참고] 1족 알칼리 금속의 산화수가 항상 +1인 이유
원자가 전자가 1개이고, 전기음성도가 가장 작은 족이기 때문.
---------------------------------------------------
※ 산화수 구하는 순서(방법) (우선 순위)
화합물 또는 다원자 이온에서 각 원자의 산화수를 구하는 순서는
첫째, 지존 원자(넘버 1)의 산화수를 우선 할당한다.
둘째, 수소 원자(넘버 2)의 산화수를 우선 할당한다.
셋째, 산소 원자(넘버 3)의 산화수를 우선 할당한다.
( 만약 넘버 1, 2, 3가 없고, 대신 넘버 1, 2, 3의 사촌(같은 족) 원자가 있다면,
사촌 원자의 산화수를 우선 할당한다. 아래에 나오는 예제 참고. )
끝으로, 위 4) 또는 5) 규칙에 따라 나머지 원자의 산화수를 구한다.
---------------------------------------------------
산화수를 구할 때, 절대 산화수라는 게 있습니다.
여기서 절대란 절대로 변하지 않는, 예외가 있을 수 없는 산화수란 의미입니다.
( 절대 산화수, 넘버 1, 넘버 2, 넘버 3는
학생들이 산화수 규칙을 외우는데 도움 되게끔 제가 만든 용어입니다.^^ )
절대 산화수를 가지는 원자는 다음과 같습니다.
1) 알칼리금속, 즉 1A족 원소로써, 항상 +1의 산화수를 갖습니다.
2) 알칼리토금속, 즉 2A족 원소로써, 항상 +2의 산화수를 갖습니다.
3) 할로겐족인 F는 항상 –1의 산화수를 갖습니다.
( F만 항상 –1입니다. 나머지 할로겐족 원소는
–1, +1, +3, +5, +7의 산화수를 가질 수 있습니다. )
( 참고: 할로겐간 화합물 https://ywpop.tistory.com/5516 )
그 다음으로,
거의 절대 산화수에 가까운 산화수를 가지는 원자가 2개 있습니다.
1) H는 대부분 +1의 산화수를 갖습니다.
( 단, NaH에서처럼, 넘버 1인 Na의 산화수 = +1 이므로, H의 산화수 = –1. )
2) O는 대부분 –2의 산화수를 갖습니다.
( 단, H2O2에서처럼, 넘버 2인 H의 산화수 = +1 이므로, O의 산화수 = –1. )
따라서 화합물 또는 다원자이온에서 이들 원자의 산화수를 먼저 정한 다음에
나머지 원자의 산화수를 정하면 됩니다.
---------------------------------------------------
예제 1) SnBr4에서 Sn의 산화수
---> 넘버 1, 넘버 2, 넘버 3, 모두 없다.
---> 넘버 1의 사촌인 Br(할로겐족)이 넘버 1 역할을 한다.
---> Br의 산화수 = –1 이므로, Sn의 산화수 = +4.
예제 2) Cu2S에서 Cu의 산화수
---> 넘버 1, 넘버 2, 넘버 3, 모두 없다.
---> 넘버 3의 사촌인 S(산소족)가 넘버 3 역할을 한다.
---> S의 산화수 = –2 이므로, Cu의 산화수 = +1.
( S는 산소족 원소이므로, S의 산화수는 O와 같다. )
예제 3) SCl2에서 S의 산화수
---> 넘버 1, 넘버 2, 넘버 3, 모두 없다.
---> 넘버 1의 사촌인 Cl(할로겐족)이 넘버 1 역할을 한다.
---> Cl의 산화수 = –1 이므로, S의 산화수 = +2.
( Cl은 넘버 1의 사촌이고, S는 넘버 3의 사촌인데,
다른 가족의 사촌끼리 붙으면, 서열이 더 높은 가족의 사촌이 이긴다. )
( 간단히 설명하면, Cl, Br, I는 넘버 4쯤 된다. )
---------------------------------------------------
▶ 이온결합 화합물의 산화수
양이온은 전자(–1 전하)를 잃어서 +전하를 띤 상태이고,
음이온은 전자를 얻어서 –전하를 띤 상태이므로,
각 원자의 산화수 = 각 이온의 전하.
예) NaCl에서, Na의 산화수 = +1, Cl의 산화수 = –1.
▶ 공유결합 화합물의 산화수
전기음성도가 더 큰 원자가 공유 전자쌍을 모두 차지한다고 가정한다.
따라서 전기음성도가 더 큰 원자는 공유 전자쌍의 개수만큼 –전하를 띠고,
전기음성도가 더 작은 원자는 공유 전자쌍의 개수만큼 +전하를 띤다.
예) NH3에서, N의 산화수 = –3, H의 산화수 = +1.
( 참고: 형식 전하 https://ywpop.tistory.com/2544 )
[ 참고: 유기화합물의 산화수 계산 https://ywpop.tistory.com/7863 ]
▶ 그렇다면, 산화수 구하는 규칙을 외우지 않아도 될 것 같다는 생각이 든다...
면, 그것은 오산, 오판, 아주 잘못된 생각이다. 왜냐하면,
모든 원소의 전기음성도를 외우는 것이 훨씬 더 머리 아프며, 또한
예로 든 물질처럼 달랑 2개 종류의 원소로만 이루어진 물질만 있는 것이 아니기 때문이다.
만약 K2Cr2O7, KMnO4, NH4ClO4에서 각 원자의 산화수를 전기음성도 차이로만 계산할 수 있다면,
산화수 구하는 규칙을 외우지 않아도 된다.
[참고] 전기음성도로 산화수를 계산하면 오류가 발생하는 경우도 있다.
HNO3에서 전기음성도 차이로 질소의 산화수를 계산하면, +4가 나온다.
( 참고: HNO3의 루이스 구조 https://ywpop.tistory.com/7669 )
▶ 화학책에서 책 저자들이 산화수 구하는 규칙(우선순위)을 소개하는 것은
( 책 저자들이 시간이 남아돌아서 또는 책의 분량을 늘이기 위해서가 아니라, )
화학 초보자들이 산화수를 구하는데 도움이 되기 때문입니다.
저 역시 같은 이유로 이 글을 작성하였으니, 산화수 규칙은 외우길 권장합니다.
[참고] 산화수 계산 예제 검색 방법
화면 상단 오른쪽에 있는 검색창에다
“의 산화수”를 입력해 보세요.

물질명을 포함시켜 검색해도 됩니다.
가령 KMnO4에서 Mn의 산화수를 알고 싶다면,
“KMnO4의 산화수”라고 입력하면 됩니다.
[ 관련 글 https://ywpop.tistory.com/16811 ] 몇 가지 화합물에서 질소(N)의 산화수
[ 관련 글 https://ywpop.tistory.com/3099 ] 몇 가지 화합물에서 황(S)의 산화수
[ 관련 글 https://ywpop.tistory.com/19428 ] 전이금속을 포함하는 화합물의 산화수
[ 유튜브 https://youtu.be/Xt8URu4Z86g ]
[ 관련 글 https://ywpop.blogspot.com/2023/09/blog-post_40.html ]
화학 반응이 일어날 때는 전자가 이동한다.
모든 화학 반응은 전자의 이동을 수반한다.
[키워드] 산화수 기준, 산화수 계산 기준, 산화수 규칙 기준, 산화수 사전, 산화수 계산 사전, 산화수 규칙 사전, 산화수 경전
[Google 검색 실적] 2023년 12월 상위 실적
'일반화학 > [04장] 수용액 반응' 카테고리의 다른 글
| 매우 묽은 농도의 강산 강염기 용액의 pH (1) | 2014.11.05 |
|---|---|
| 이온결합 화합물의 용해도 지침. solubility guidelines (1) | 2014.11.02 |
| 0.10 M HNO3 500 mL + 0.10 M Ca(OH)2 500 mL 혼합 용액의 pH (0) | 2014.10.18 |
| 용액의 묽힘(희석, dilution) 법칙(원리) ★ (11) | 2014.10.07 |
| 산과 염기의 정의. definition of acid and base ★ (8) | 2014.07.21 |
| 용액의 농도(concentration) 표시법 ★ (2) | 2014.07.03 |
| 분자 반응식, 이온 반응식, 알짜 이온 반응식 ★ (2) | 2014.04.30 |
| 부피 분석법과 적정 (0) | 2012.06.30 |




댓글