원자단이 있는 이온결합 화합물의 산화수 구하기
FeSO4, Iron(II) sulfate와 Cu(NO3)2, Copper(II) nitrate의 oxidation number
[참고] 산화수 구하는 규칙(rule)
[ https://ywpop.tistory.com/2719 ]
이와 같은 문제를 “쉽게” 풀기 위해서는
원자단의 이온 전하 값을 미리 알고 있어야 합니다.
이런 저런 이유로 자주 나오는 원자단은
평소에 미리 암기해 두어야 합니다.
( 참고: 원자단 https://ywpop.tistory.com/2968 )
FeSO4 에서,
황산 이온, SO4^2-의 이온 전하 = –2 이므로,
(Fe) + (SO4) = 0
(Fe) + (–2) = 0
---> Fe의 산화수 = +2.
SO4^2- 에서,
O의 산화수 = –2 (넘버 3) 이므로,
(S) + 4(O) = –2
(S) + 4(–2) = –2
---> S의 산화수 = +6.
( 참고: FeSO4의 산화수 https://ywpop.tistory.com/9252 )
FeSO4(aq) → Fe^2+(aq) + SO4^2-(aq) 또는

이렇게 양이온의 산화수를 따로 먼저 구한 다음,
원자단에서 각 원자의 산화수를 구합니다.
Fe(NH3)6^3+ 에서,
NH3은 중성 분자이므로,
Fe의 산화수 = 이온 전하 = +3.
NH3 에서,
H의 산화수 = +1 (넘버 2) 이므로,
(N) + 3(H) = 0
(N) + 3(+1) = 0
---> N의 산화수 = –3.

Cu(NO3)2 에서,
질산 이온, NO3^-의 이온 전하 = –1 이므로,
(Cu) + 2(NO3) = 0
(Cu) + 2(–1) = 0
---> Cu의 산화수 = +2.
NO3^- 에서,
O의 산화수 = –2 (넘버 3) 이므로,
(N) + 3(O) = –1
(N) + 3(–2) = –1
---> N의 산화수 = +5.
( 참고: Cu(NO3)2의 산화수 https://ywpop.tistory.com/7590 )
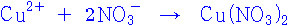
[ 관련 글 https://ywpop.tistory.com/19428 ]
전이금속 또는 원자단을 포함한 화합물의 이온전하(산화수)
[키워드] 이온결합 화합물의 산화수 기준, FeSO4의 산화수 기준, Fe(NH3)6^3+의 산화수 기준, Cu(NO3)2의 산화수 기준
'일반화학 > [04장] 수용액 반응' 카테고리의 다른 글
| 구연산과 탄산수소나트륨의 반응. 구연산과 베이킹소다의 반응 (1) | 2015.06.20 |
|---|---|
| 알짜이온반응식. Na2CO3 + CaCl2. CaCO3 침전 (3) | 2015.04.07 |
| 금속의 활동도 계열. Activity Series of Metals ★ (6) | 2015.02.26 |
| 산소의 득실과 산화-환원 반응의 동시성 ★ (0) | 2014.11.25 |
| 화학 반응에서 염(salt)이란 (0) | 2014.11.13 |
| 산화-환원 반응에서 불균등화 반응 ★ (0) | 2014.11.08 |
| 매우 묽은 농도의 강산 강염기 용액의 pH (1) | 2014.11.05 |
| 이온결합 화합물의 용해도 지침. solubility guidelines (1) | 2014.11.02 |




댓글