LiAlH4의 산화수. NaH의 산화수
LiAlH4에서 수소의 산화수는 얼마인가?
---------------------------------------------------
▶ 참고: 산화수 구하는 규칙(rule)
[ https://ywpop.tistory.com/2719 ]
---------------------------------------------------
LiAlH4 에서,
Li의 산화수 = +1 (넘버 1) 이고,
Al의 산화수 = +3 이므로,
( Al은 따로 설명 안 했지만, 넘버 1처럼 항상 +3의 산화수를 가진다. )
(Li) + (Al) + 4(H) = 0
(+1) + (+3) + 4(H) = 0
따라서
H의 산화수 = –1.
또는
LiAlH4의 화합물명은 lithium aluminium hydride이다.
hydride는 수소의 이온 전하가 –1, 즉 음이온임을 의미한다.
( NaCl, sodium chloride에서처럼, -ide 접미사는 음이온에 붙는다. )
( 참고: 음이온 명명법 https://ywpop.tistory.com/7881 )
예를 들어, sodium hydride, NaH에서
수소의 산화수는 –1이다.
NaH 에서,
Na의 산화수 = +1 (넘버 1) 이므로,
(Na) + (H) = 0
(+1) + (H) = 0
따라서
H의 산화수 = –1.

[참고] 알칼리금속 화합물, 알칼리토금속 화합물에서
수소의 산화수 = –1.
알칼리금속(1족)과 알칼리토금속(2족)의 산화수 서열이
넘버 1 (절대산화수)임을 잊지마라.
따라서
알칼리금속 + 수소 화합물, 알칼리토금속 + 수소 화합물에서
알칼리금속과 알칼리토금속은 각각 +1, +2의 산화수를 가지므로,
수소의 산화수는 –1이 된다.(–1이 될 수밖에 없다.)
[ 관련 글 https://ywpop.tistory.com/10298 ] CaH2의 산화수

에서, 수소의 산화수 = –1.
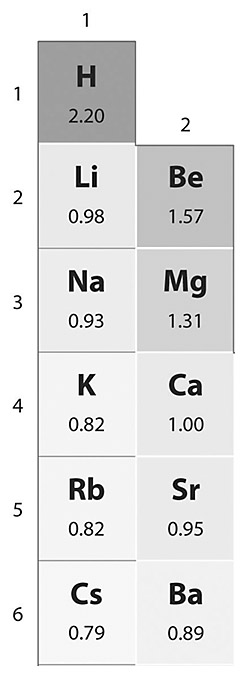
[참고] 수소 음이온을 설명하는 수소의 전기음성도
( 참고: 전기음성도 https://ywpop.tistory.com/2567 )
수소의 전기음성도(2.20)는
알칼리금속, 알칼리토금속보다 크다.
모든 화합물은 공유 결합 성격을 가지므로,
가령 Na와 H가 공유 결합했다고 가정하면,
전기음성도가 더 큰 수소가 공유전자쌍을 더 많이 차지할 것이므로,
( 수소가 공유전자쌍을 자신쪽으로 끌어당기기 때문에, )
H에 δ–의 부분 음전하가 할당되고,
Na에 δ+의 부분 양전하가 할당될 것이다.
[ 관련 글 https://ywpop.tistory.com/19563 ] 수소의 산화수가 +1인 이유
[ 관련 글 https://ywpop.tistory.com/23604 ]
수소의 이온화. 수소 양이온과 수소 음이온
[ 관련 글 https://ywpop.tistory.com/7962 ]
붕소의 산화수. BH3의 산화수. NaBH4의 산화수
[키워드] 수소의 산화수 기준, H의 산화수 기준, 수소의 산화수 사전, H의 산화수 사전, 수소 음이온 기준, 수소 음이온 사전
'일반화학 > [04장] 수용액 반응' 카테고리의 다른 글
| CuO의 산화수. Cu2O의 산화수 (1) | 2018.07.21 |
|---|---|
| CO3^2-의 산화수. 탄산이온의 산화수 (0) | 2018.07.02 |
| 알짜이온반응식. H2CO3 + Ca(OH)2. CaCO3 침전반응 (0) | 2018.06.30 |
| FeSO4의 산화수. iron(II) sulfate의 산화수 (0) | 2018.06.11 |
| CrO4^2- → Cr2O7^2- 반응은 산화-환원 반응인가 (0) | 2018.06.04 |
| AgNO3의 산화수 (0) | 2018.06.04 |
| redox Zn + HCl. redox Zn(s) + HCl(aq) ★ (0) | 2018.05.27 |
| NO3^-의 산화수. 질산 이온의 산화수 (0) | 2018.05.14 |
댓글