0.10 M HNO3 500 mL + 0.10 M Ca(OH)2 500 mL 혼합 용액의 pH
강산-강염기 중화반응. HNO3 + Ca(OH)2
0.10 M HNO3 500 mL 용액과
0.10 M Ca(OH)2 500 mL 용액을 혼합했을 때,
이 혼합 용액의 pH를 구하시오.
---------------------------------------------------

강산 1몰당 수소 이온(H^+) 1몰이 이온화되므로,
H^+ 이온의 mol수 = (0.1 mol/L) × 0.5 L = 0.05 mol
( 참고: MV = mol https://ywpop.tistory.com/7787 )

강염기 1몰당 수산화 이온(OH^-) 2몰이 이온화되므로,
OH^- 이온의 mol수 = (0.1 mol/L) × 0.5 L × 2 = 0.10 mol
[중화 반응의 알짜 이온 반응식 (net ionic equation)]
다음 반응이 중화 반응의 글자 그대로 알짜, 즉 본질이다.

H^+ : OH^- = 1 : 1 계수비(= 몰수비) 이고,
“H^+ 이온의 mol수 < OH^- 이온의 mol수” 이므로,
1 : 1 중화 반응 결과 남아있는 것은 0.05 mol OH^-.
이때 OH^- 이온의 몰농도 = 0.05 mol / 1.0 L = 0.05 M
OH^- 이온의 몰농도로부터 pOH를 계산하면,
pOH = –log[OH^-]
= –log(0.05) = 1.3
따라서 용액의 pH는
pH = 14 – pOH
= 14 – 1.3 = 12.7
답: pH = 12.7
---------------------------------------------------
Calculate the resulting pH
if 365 mL of 2.88 M HNO3 solution is mixed with
335 mL of 1.10 M Ca(OH)2 solution.
---------------------------------------------------
(1) H^+ 이온의 mol수 = (2.88 mol/L) × 0.365 L = 1.0512 mol
(2) OH^- 이온의 mol수 = (1.10 mol/L) × 0.335 L × 2 = 0.737 mol
(3) 1.0512 mol – 0.737 mol = 0.3142 mol H^+
(4) 전체 용액의 부피 = 0.365 L + 0.335 L = 0.7 L
(5) H^+의 몰농도 = 0.3142 mol / 0.7 L = 0.449 M
(6) pH = –log[H^+] = –log(0.449) = 0.348
---------------------------------------------------
① 혼합 용액의 pH를 계산할 때와
② 특정 양의 산(또는 염기)을 중화시킬 때
필요한 염기(또는 산)의 양을 계산할 때,
반응식에 나와 있는 계수를 적용하는 방법이
다르다는 것에 주의할 것.
예) 25.0 mL 0.100 M HNO3 용액을
중화시키는데 필요한 Ca(OH)2의 질량은?
---------------------------------------------------
① 균형 맞춘 반응식 쓰기
2HNO3 + Ca(OH)2 → Ca(NO3)2 + 2H2O
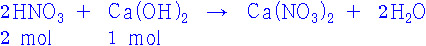
[주의] 혼합 용액의 pH를 결정할 때는
위 균형 맞춘 반응식을 사용하면 안 된다.
② 산의 몰수 계산
(0.1 mol/L) × 0.025 L = 0.0025 mol
③ 산 중화에 필요한 염기의 몰수 계산
산 : 염기 = 2 : 1 계수비(= 몰수비) 이므로,
산 : 염기 = 2 : 1 = 0.0025 mol : ? mol
? = 0.0025 / 2 = 0.00125 mol
④ Ca(OH)2의 질량 계산
Ca(OH)2의 몰질량 = 74.09 g/mol 이므로,
0.00125 mol × (74.09 g/mol) = 0.0926 g
( 참고: n = W/M https://ywpop.tistory.com/7738 )
[키워드] HNO3 + Ca(OH)2 기준문서, HNO3 + Ca(OH)2 반응 기준문서
'일반화학 > [04장] 수용액 반응' 카테고리의 다른 글
| 화학 반응에서 염(salt)이란 (0) | 2014.11.13 |
|---|---|
| 산화-환원 반응에서 불균등화 반응 ★ (0) | 2014.11.08 |
| 매우 묽은 농도의 강산 강염기 용액의 pH (1) | 2014.11.05 |
| 이온결합 화합물의 용해도 지침. solubility guidelines (1) | 2014.11.02 |
| 용액의 묽힘(희석, dilution) 법칙(원리) ★ (11) | 2014.10.07 |
| 산화수 구하는 규칙(rule) ★★ (14) | 2014.07.30 |
| 산과 염기의 정의. definition of acid and base ★ (8) | 2014.07.21 |
| 용액의 농도(concentration) 표시법 ★ (2) | 2014.07.03 |




댓글