용액의 묽힘(희석, dilution) 법칙(원리)
---------------------------------------------------
▶ 참고: 제4장 수용액 반응. 목차
[ https://ywpop.tistory.com/15191 ]
---------------------------------------------------
화학 실험할 때 진한 용액을 많이 만들어놓고,
필요한 농도는 진한 용액을 묽혀서 사용하는 경우가 있습니다.
가령, 어떤 실험에 1 M, 0.75 M, 0.5 M, 0.25 M 황산구리 용액이
각각 50 mL씩 필요하다면,
각 농도에 해당하는 황산구리의 질량을 따로 계산해서
각각 저울에 달아, 각각의 용량 플라스크에 넣고
표시선까지 물을 채워 해당 농도의 용액을 만드는 대신,
1 M 황산구리 용액을 한 250 mL 정도 정성들여 여유 있게 만든 다음,
이 용액을 묽혀서 나머지 용액을 제조합니다.
이렇게 하면, 시간과 돈을 절약할 수 있고,
무엇보다 각 용액의 오차도 줄일 수 있습니다.
( 묽은 용액일수록, 넣어야 할 용질의 질량이 작으므로,
전자저울로 용질의 질량을 잴 때 오차가 더 발생할 수 있습니다. )
( 이 설명이 부족하다면... https://ywpop.tistory.com/6695 )
이때 필요한 이론이 용액의 묽힘(희석) 법칙(원리)인데,
이 원리를 이용한 계산 식(공식) 자체는 매우 간단합니다.

(진한 용액의 농도) (진한 용액의 양) = (묽은 용액의 농도) (묽은 용액의 양)
또는 간단히,


[농도 × 부피 = (mol/L) × L = mol] 이기 때문에,
[진한 용액 속의 용질의 몰수 = 묽은 용액 속의 용질의 몰수]
( 참고 https://ywpop.tistory.com/3324 )
( 여기서 M, V는 각각 용액의 농도, 용액의 양을 대표하는 기호입니다. )
( 따라서 몰농도 대신 노르말농도 또는 퍼센트농도를,
부피 대신 질량을 대입해도 성립합니다. )
진한 용액 일정량에다 용매를 가해서
묽은 용액을 만들 때, 즉 용액을 묽힐 때,
묽히기 전/후 용액에 들어있는 용질의 양은
변함없다(즉, 일정하다)는 사실에 근거한 계산 식입니다.
MV = M’V’ 에서, MV = (mol/L) × L = mol
---> 묽히기 전/후 용액에 들어있는 용질의 mol수는 같다.
NV = N’V’ 에서, NV = (eq/L) × L = eq
---> 묽히기 전/후 용액에 들어있는 용질의 eq수(당량수)는 같다.
( 퍼센트농도와 질량을 사용한 예제 https://ywpop.tistory.com/5451 )
( 묽힘법칙과 유사한 관계식: C × V × D = c × v × d )
( 참고 https://ywpop.tistory.com/5711 )
[참고] 산-염기 중화적정 시 시료의 농도 결정
( aMV = bM’V’ https://ywpop.tistory.com/4689 )
[ 관련 글 https://ywpop.tistory.com/9420 ] M1V1 + M2V2 = M3V3

이론에 대해서는 더 이상 설명할 것이 없습니다. 매우 간단하다고 했죠.^^
이제 예제를 통해 이 법칙을 이용해 보겠습니다.
[예제] 0.10 M 황산 용액 450 mL를 만들 때,
3.0 M 황산 용액은 몇 mL 필요한가?
---------------------------------------------------
[풀이]
MV = M’V’
3.0 M × ? mL = 0.10 M × 450 mL
? mL = (0.10 M × 450 mL) / 3.0 M = 15 mL
3.0 M 황산 용액 15 mL를 피펫으로 분취하여 메스실린더에 넣고,
450 mL까지 물로 채우면, 0.10 M 황산 용액 450 mL가 됩니다.

( 18 M 정도 되는 진한 황산일 경우에는
① 먼저 메스실린더에 물을 대략 400 mL쯤 채워 놓는다.
② 황산을 조금씩(한 방울씩) 가해, 15 mL를 다 가한다.
③ 마지막으로 450 mL까지 다시 물로 채운다. )
[참고] 용액을 묽힐 때는, 일반적으로,
부피 플라스크(volumetric flask)를 사용한다.
[ 진한 황산(18 M)을 묽힐 때 주의사항 https://ywpop.tistory.com/2828 ]
[ 다른 예제 https://ywpop.tistory.com/2857 ]
[예제] 50% 용액으로 10% 용액 200 kg을 만드시오.
---------------------------------------------------
MV = M’V’
( 여기서 M, V는 각각 용액의 농도, 용액의 양을 대표하는 기호입니다. )
( 따라서 몰농도 대신 퍼센트농도, 부피 대신 질량을 대입해도 성립합니다. )
50% × ? kg = 10% × 200 kg
? = 10 × 200 / 50 = 40 kg
50% 용액 40 kg과 물 160 kg을 혼합하면,
10% 용액 200 kg이 됩니다.
검산하면, 50% 용액 40 kg에 들어있는 용질의 양은 20 kg이므로,
40 kg 용액 × (50/100) = 20 kg 용질
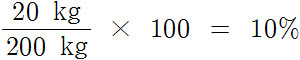
[ 관련 예제 목록 https://ywpop.tistory.com/search/MV = M’V’ ]
---------------------------------------------------
진한 용액을 묽힐 때, 묽히기 전 용질의 몰수와 묽힌 후 용질의 몰수는 같다?
사과 5개와 배 5개가 한 바구니(A)에 들어 있습니다.
사과와 배의 크기/질량이 모두 같다고 가정하면,
사과의 퍼센트 농도는 50%입니다.
이 바구니에서 사과 2개, 배 2개를 꺼내서 다른 바구니(B)에 넣습니다.
이 바구니(B) 역시 사과의 농도는 50%입니다.
[(사과 2개) / (사과 2개 + 배 2개)] × 100
= [(2) / (2 + 2)] × 100 = 50%
( 묽히기 전 )
이제 이 바구니(B)에다 배를 6개 넣습니다.
이때 바구니(B)의 사과 농도는 20%가 됩니다.
[(사과 2개) / (사과 2개 + 배 2개 + 배 6개)] × 100
= [(2) / (2 + 2 + 6)] × 100 = 20%
( 묽힌 후 )
묽히기 전이나, 묽힌 후나
바구니(B)에 들어있는 사과의 개수는 2개로 변함이 없습니다.
---------------------------------------------------
또는
중학교 2학년 1학기 수학, 연립방정식의 활용, 농도에 관한 문제에서...
10% 소금물에 물을 더 넣어 6% 소금물 500 g을 만들려고 한다.
물을 몇 g 더 넣어야 하는지 구하여라.
10% 소금물의 양 = x, 물의 양 = y 라 두면,
x + y = 500
그리고
“10% 소금물에 들어있는 소금의 양 = 6% 소금물에 들어있는 소금의 양” 이므로,
(10/100) × x = (6/100) × 500 <--- 이 식이 묽힘법칙의 원조격입니다.^^
x = [(6/100) × 500] / (10/100) = 300 g
y = 500 – 300 = 200 g
[ 참고: 퍼킨스 계산법 https://ywpop.tistory.com/6115 ]
[ 관련 글 https://ywpop.tistory.com/11992 ] stock solution을 희석시켜 working solution 제조방법
[ 관련 예제 https://ywpop.tistory.com/13146 ] 35% HCl(d 1.19)을 10% HCl로 만들려면 35% HCl과 물의 부피비는?
[키워드] 묽힘 기준, mv 기준, ㅡㅍ 기준, mv rlwns, mv 사전, mv dic, 묽힘법칙 기준, 묽힘법칙 사전
'일반화학 > [04장] 수용액 반응' 카테고리의 다른 글
| 산화-환원 반응에서 불균등화 반응 ★ (0) | 2014.11.08 |
|---|---|
| 매우 묽은 농도의 강산 강염기 용액의 pH (1) | 2014.11.05 |
| 이온결합 화합물의 용해도 지침. solubility guidelines (1) | 2014.11.02 |
| 0.10 M HNO3 500 mL + 0.10 M Ca(OH)2 500 mL 혼합 용액의 pH (0) | 2014.10.18 |
| 산화수 구하는 규칙(rule) ★★ (14) | 2014.07.30 |
| 산과 염기의 정의. definition of acid and base ★ (8) | 2014.07.21 |
| 용액의 농도(concentration) 표시법 ★ (2) | 2014.07.03 |
| 분자 반응식, 이온 반응식, 알짜 이온 반응식 ★ (2) | 2014.04.30 |




댓글