3p 부껍질에 존재하는 모든 전자의 양자수 세트
3p 부껍질에 존재하는 모든 전자의 양자수 세트 원자의 3p 부껍질에 존재하는 모든 전자에 대한 양자수의 완전한 세트를 쓰시오. --------------------------------------------------- ▶ 참고: 한 벌의 양자수 [ https://ywpop.tistory.com/2932 ] > Al의 3p^1 ~ Ar의 3p^6 --------------------------------------------------- ▶ 3p^1: (3, 1, –1, +1/2) ▶ 3p^2: (3, 1, 0, +1/2) ▶ 3p^3: (3, 1, +1, +1/2) ▶ 3p^4: (3, 1, –1, –1/2) ▶ 3p^5: (3, 1, 0, –1/2) ▶ 3p^6: (3, 1, +1, –1/2) [키..
2019. 5. 24.
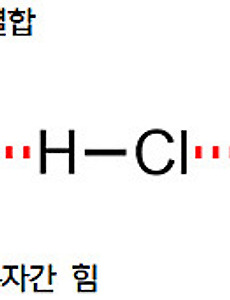 분자간 힘과 화학결합을 구별하자
분자간 힘과 화학결합을 구별하자 ▶ 분자간 힘 = 분자 사이의 상호작용 (인력) ▶ 화학결합 = 분자내 원자간 화학결합, 원자 사이의 화학결합 “분자간 힘(= 분자간 상호작용) = 반데르발스 힘” 이고,( 참고 https://ywpop.tistory.com/2579 ) 이온결합, 공유결합, 금속결합은분자간 힘이 아니다. 이온결합, 공유결합, 금속결합은“분자내 원자간 화학결합”이며,( 참고 https://ywpop.tistory.com/3036 ) 화학결합의 결합 세기(에너지)는분자간 힘의 세기와 비교할 수 없을 정도로 훨씬 더 크다. 예를 들면, 이온결합 (해리, 파괴)에너지는 400~4000 kJ/mol이고,수소결합 (해리, 파괴)에너지는 10~40..
2019. 5. 10.
분자간 힘과 화학결합을 구별하자
분자간 힘과 화학결합을 구별하자 ▶ 분자간 힘 = 분자 사이의 상호작용 (인력) ▶ 화학결합 = 분자내 원자간 화학결합, 원자 사이의 화학결합 “분자간 힘(= 분자간 상호작용) = 반데르발스 힘” 이고,( 참고 https://ywpop.tistory.com/2579 ) 이온결합, 공유결합, 금속결합은분자간 힘이 아니다. 이온결합, 공유결합, 금속결합은“분자내 원자간 화학결합”이며,( 참고 https://ywpop.tistory.com/3036 ) 화학결합의 결합 세기(에너지)는분자간 힘의 세기와 비교할 수 없을 정도로 훨씬 더 크다. 예를 들면, 이온결합 (해리, 파괴)에너지는 400~4000 kJ/mol이고,수소결합 (해리, 파괴)에너지는 10~40..
2019. 5. 10.