분자간 힘과 화학결합을 구별하자
▶ 분자간 힘 = 분자 사이의 상호작용 (인력)
▶ 화학결합 = 분자내 원자간 화학결합, 원자 사이의 화학결합
“분자간 힘(= 분자간 상호작용) = 반데르발스 힘” 이고,
( 참고 https://ywpop.tistory.com/2579 )
이온결합, 공유결합, 금속결합은
분자간 힘이 아니다.
이온결합, 공유결합, 금속결합은
“분자내 원자간 화학결합”이며,
( 참고 https://ywpop.tistory.com/3036 )
화학결합의 결합 세기(에너지)는
분자간 힘의 세기와 비교할 수 없을 정도로 훨씬 더 크다.
예를 들면, 이온결합 (해리, 파괴)에너지는 400~4000 kJ/mol이고,
수소결합 (해리, 파괴)에너지는 10~40 kJ/mol이다.
( 참고 https://en.wikipedia.org/wiki/Intermolecular_force )
분자간 힘의 ‘분자’라는 명칭에서 알 수 있듯이,
분자간 힘이란, 3가지 화학결합 중에서,
공유결합으로 이루어진 화합물(= 분자)들
사이에 존재하는 힘(상호작용, 인력)을 의미한다.
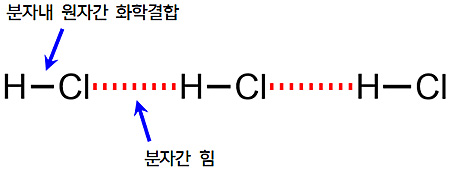
▶ intramolecular forces and intermolecular forces
> intramolecular forces = 분자내 힘 = 화학 결합
> intermolecular forces = 분자간 힘 = 반데르발스 힘
( 참고: www.khanacademy.org )
[ 관련 글 https://ywpop.tistory.com/5995 ] 화학 결합과 분자간 힘
[키워드] 화학결합과 분자간힘 기준, 분자간힘과 화학결합 기준, 구분하자 기준, 분자내 힘과 분자간 힘의 차이
'일반화학 > [11장] 액체와 분자간의 힘' 카테고리의 다른 글
| 4620 J이 흡수될 때 끓는점에서 증발하는 에탄올의 질량(g) (0) | 2020.06.11 |
|---|---|
| CH2Cl2 21.9℃ 381.0 mmHg 26.9℃ 465.8 mmHg (0) | 2020.06.07 |
| 끓는점이 더 높은 것. CO2 또는 CS2 (2) | 2020.05.21 |
| 용융열과 증발열의 합은 승화열과 같다 (0) | 2019.10.25 |
| 수소결합 그래프의 2가지 이상한 점. 이걸 어찌 설명할꼬? (0) | 2018.03.14 |
| 물질의 상태변화. 승화 (0) | 2017.11.16 |
| C2H5OH와 CH3OCH3의 끓는점 비교 (0) | 2017.10.10 |
| 극성분자와 런던분산력 (1) | 2017.09.14 |


댓글