[화학 반응 속도] 시계 반응 실험
---------------------------------------------------
1. 실험 목적
화학 반응 속도는 ① 반응물 농도, ② 반응 온도, 그리고 ③ 촉매의 영향을 받는다.
( 참고 https://ywpop.tistory.com/10421 )
이 실험에서는 반응물의 농도 변화에 따른 반응 속도를 측정함으로써
반응 속도에 미치는 농도의 영향을 알아보고, 또한 반응 차수 및 속도 상수를 구한다.
2. 이론

> 반응 속도: 시간에 따른 반응물 또는 생성물의 농도 변화
> 속도 법칙: 반응 속도를 속도 상수와 반응물의 초기 농도와의 관계로 나타낸 식
( 참고 https://ywpop.tistory.com/2668 )
반응 속도는 단위 시간당 반응물 또는 생성물의 농도 변화로 정의되며,
반응물 중의 하나가 소모되는 속도
(또는 생성물 중의 하나가 생성되는 속도)를 관찰하여 결정할 수 있지,
화학 반응식만으로는 결코 그 값을 알 수 없다.
즉, 반응 속도는 실험을 통해서만 결정할 수 있다.
( 참고 https://ywpop.tistory.com/30 )

여기서 k는 속도 상수, m과 n은 반응 차수이다.
반응 차수는 실험에 의해 결정되며(보통 0, 1, 2와 같은 정수),
화학량론적 계수인 a, b와는 무관하다.
다음과 같은 요오드화 이온과 과산화이황산 이온과의 반응을 살펴보자.

여기서 이온의 농도는 mol/L로 나타낸다.
반응 속도는 (2)식에서 보듯이 반응물의 농도에 영향을 받는다.
이 밖에도 반응 속도는 온도와 촉매의 영향을 받지만
이 실험에서는 반응 속도에 미치는 농도의 영향만을 살펴볼 것이다.

반응 (3)은 반응 (1)에 비하여 훨씬 빨리 진행된다.
그러므로 반응 (1)에서 생성된 I2 분자는
같은 반응 용기에 들어 있는 S2O3^2- 이온과 재빨리 반응하여 없어지게 되어
S2O3^2- 이온이 완전히 소모되지 않은 한 I2 분자의 농도는 영(zero)이다.
반응이 진행되어 S2O3^2- 이온이 모두 소모되면
반응 (1)만이 일어나므로 I2 분자가 용액 속에 남게 된다.
이 I2 분자가 녹말과 반응하여 청색의 착물을 형성,
그 결과 용액의 색깔이 청색을 띠게 되어
일정량의 S2O3^2- 이온이 모두 반응하여 없어지는데
소요되는 시간을 알 수 있게 된다.
( 보충설명 https://ywpop.tistory.com/22823 )
반응 (1)에서 1몰의 S2O3^2- 이온에 의해서 1몰의 I2 분자가 생성되는데,
이 1몰의 I2 분자는 반응 (3)에 따라 2몰의 S2O3^2- 이온과 반응한다.
그러므로 반응이 시작되어 청색이 나타나는 순간까지 소모된 S2O3^2- 이온의 몰수는

따라서 일정량의 I^- 이온 및 S2O3^2- 이온의 양을 정확히 재어 반응 용기에 넣고,
여기에 정확한 양을 알고 있는 소량의 S2O3^2- 이온 및 녹말을 가하여,
반응이 시작되는 순간부터 용액이 변색될 때까지의 시간을 측정하면
일정량의 반응물이 반응하는데 소요되는 시간을 알 수 있으므로 반응 속도를 구할 수 있다.
반응 속도는 단위 시간에 감소하는 반응물의 농도로써 주어지므로
여러 가지 농도를 써서 위와 같은 실험을 하면
반응 속도를 구하는데 필요한 데이터를 얻을 수 있다.
3. 기구 및 시약

4. 실험 방법
1) 다음 표와 같은 용액을 조제한다.
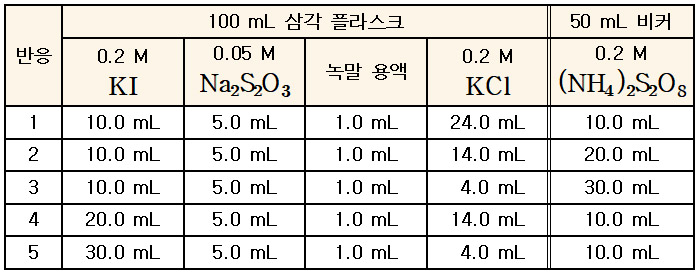
2) 100 mL 삼각 플라스크(반응 플라스크) 및 50 mL 비커에
조제한 용액을 상기 표의 양만큼 피펫을 사용하여 각각 정확하게 가해 놓는다.
3) 반응 플라스크에 magnetic bar를 넣고 교반기를 작동시킨다. 초시계를 준비한다.
4) 50 mL 비커 속의 용액을 신속하게 반응 플라스크에 가한다.
동시에 반응 시작 시간을 기록한다.
5) 반응 용액이 청색으로 변할 때까지의 시간을 기록한다.

1) 녹말 용액 조제법: 끓고 있는 증류수 50 mL에 약 0.5 g의 녹말을 넣고
맑은 용액이 될 때까지 끓인다(100 mL 삼각 플라스크 사용).
2) (NH4)2S2O8 용액은 오래(며칠 동안) 방치하면 분해되므로
사용 직전에 조제한다.
3) 반응 혼합물을 희석시킬 때(똑같은 양, 50 mL로 만들 때)
물 대신 KCl 용액을 사용하는데 이것은 반응 속도에 영향을 미치는
반응 혼합물의 이온 세기를 일정하게 유지하기 위함이다.
※ 자료 처리에 대한 내용은 [첨부 파일]을 참고하세요.
[ 관련 글 https://ywpop.tistory.com/26 ] 1차 반응
[ 관련 글 https://ywpop.tistory.com/25 ] 2차 반응

[ 관련 글 https://ywpop.tistory.com/7894 ] 비타민 C 정량분석
[키워드] 시계 반응 기준문서, 시계 반응 실험 기준문서, 시계 반응 사전, 시계 반응 실험 사전
[애드센스 리포트] 2022년 9월 인기 페이지
'일반화학 > [14장] 화학반응 속도론' 카테고리의 다른 글
| 속도상수(k)의 온도 의존성과 활성화에너지(Ea) (2) | 2016.01.16 |
|---|---|
| 속도법칙과 속도상수 구하기 (0) | 2015.10.26 |
| Arrhenius(아레니우스) 식. 속도 상수와 활성화 에너지 (1) | 2015.10.26 |
| 실험 자료로부터 속도 법칙 구하기. 초기 속도법 (0) | 2015.07.03 |
| 반응 속도. reaction rate. 평균 반응 속도 ★ (7) | 2014.07.08 |
| 활성화 에너지 (activation energy, Ea) (0) | 2012.07.02 |
| 반응 차수. 그래프를 이용한 1차와 2차 반응의 구별법 (0) | 2012.06.30 |
| 반응 차수. 2차 반응 (second order rxn) ★ (0) | 2012.06.29 |



댓글