활성화 에너지 (activation energy, Ea)
▶ 참고: 충돌 이론과 활성화 에너지
[ https://ywpop.tistory.com/32 ]
---> 이 글을 먼저 읽어보세요.
▶ 충돌하는 분자들의 전체 운동 에너지는
화학 반응에 필요한 최소한의 에너지인
활성화 에너지 이상이 되어야만 한다.
▶ 활성화 에너지
> 화학 반응에 필요한 최소한의 에너지
> 말하자면 반응할 수 있는 자격이라고나 할까?
> 그러나 활성화 에너지 이상의 에너지를 갖고 있는 분자라 해도
모두 반응하는 것은 아니다.
▶ 반응물 분자들이 활성화 에너지 이상의 에너지를 갖게 하는 가장 간단한 방법
---> 반응물 분자들이 들어있는 반응 용기(비커나 플라스크)를 가열시킨다.

[ 그림 출처 Wikimedia ] 알코올 램프로 용액을 가열시키고 있다.
화학 반응을 일으키는 가장 간단한 방법은
반응 혼합물을 가열하는 것이다.
▶ 반응물 분자들이 활성화 에너지 이상의 에너지를 갖게 하는 또 다른 방법
---> 촉매를 사용한다.
( 참고: 촉매 https://ywpop.tistory.com/5497 )
---------------------------------------------------
▶ 활성화 에너지
> 반응물이 정복(극복)해야 하는 산의 정상(고개)
---> 반응물의 위치와 산의 정상과의 높이 차이

▶ 활성화 상태 (activated state)
> 반응물이 활성화 에너지만큼 에너지를 얻은 상태
> 전이 상태(transition state)라고도 함
> 반응을 일으킬 수 있는 2가지 조건 중 하나를 만족한 상태,
방향만 맞으면 생성물로, 틀리면 다시 반응물로...
▶ 활성화 착물 (activated complex)
> 활성화 상태에 있는 매우 불안정한 중간 생성물
▶ Ea가 크다는 의미
> 반응이 일어나려면 주변에서 많은 에너지를 흡수해야 하므로,
반응이 일어나기 어렵고 반응 속도도 느리다.
▶ Ea가 작다는 의미
> 주변에서 적은 에너지를 흡수해도 반응이 일어나므로,
반응이 잘 일어나고 반응 속도도 빠르다.
---------------------------------------------------
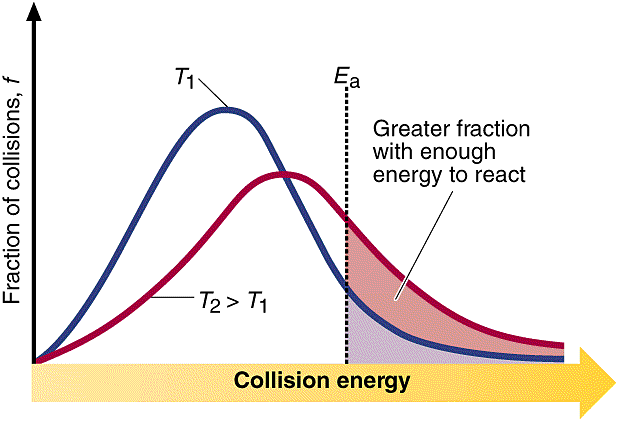
▶ 높은 온도: 반응할 수 있는 자격(충분한 에너지)을 갖춘 분자들이 더 많다.
( 참고: 충돌 모형과 온도 https://ywpop.tistory.com/471244 )
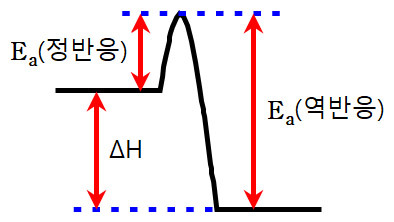
▶ 발열 반응인 경우,
역반응의 Ea > 정반응의 Ea
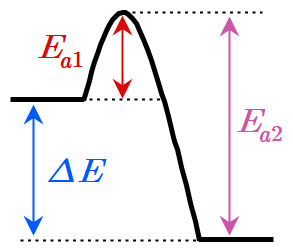
[그림] E_a1 = 정반응의 활성화에너지. E_a2 = 역반응의 활성화에너지.
( 관련 예제 https://ywpop.tistory.com/18557 )
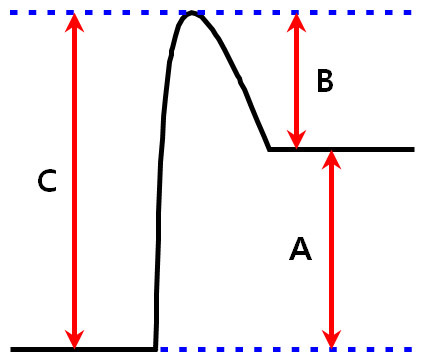
[그림] 흡열반응의 활성화에너지.
정반응의 Ea = C, 역반응의 Ea = B
→ 정반응의 Ea > 역반응의 Ea
( 관련 예제 https://ywpop.tistory.com/14628 )
[ 관련 글 https://ywpop.tistory.com/7288 ] 아레니우스 식. 속도 상수의 온도 의존성
k = Ae^(–Ea/RT)
[키워드] 활성화 에너지 기준, 활성화에너지 기준, 활성화 에너지 사전, 활성화에너지 사전, ea dic, 화학 반응이 일어나도록 하는 가장 쉬운 방법 기준, 화학 반응이 일어나도록 하는 가장 간단한 방법 기준, 화학 반응을 일으키는 가장 쉬운 방법 기준, 화학 반응을 일으키는 가장 간단한 방법 기준, 가열 기준, 가열 사전
'일반화학 > [14장] 화학반응 속도론' 카테고리의 다른 글
| Arrhenius(아레니우스) 식. 속도 상수와 활성화 에너지 (1) | 2015.10.26 |
|---|---|
| 실험 자료로부터 속도 법칙 구하기. 초기 속도법 (0) | 2015.07.03 |
| [화학 반응 속도] 시계 반응 실험 ★ (0) | 2014.07.11 |
| 반응 속도. reaction rate. 평균 반응 속도 ★ (7) | 2014.07.08 |
| 반응 차수. 그래프를 이용한 1차와 2차 반응의 구별법 (0) | 2012.06.30 |
| 반응 차수. 2차 반응 (second order rxn) ★ (0) | 2012.06.29 |
| 반응 차수. 1차 반응 (first order rxn) ★ (0) | 2012.06.28 |
| 속도 법칙(rate law)과 반응 차수(reaction order) ☆ (0) | 2012.06.27 |




댓글