반응 차수. 그래프를 이용한 1차와 2차 반응의 구별법
---------------------------------------------------
▶ 참고: 제14장 화학 반응 속도론. 목차
[ https://ywpop.tistory.com/12739 ]
---------------------------------------------------
▶ 1차 반응과 2차 반응의 직선식

▶ 1차 반응 (실험 data 및 그래프)


---> 음의 기울기, 즉 오른쪽 아래로 직선이 그려지므로,
1차 반응.
---> 1차 반응의 속도 상수, k = –기울기
( 예제: 기울기 = –k https://ywpop.tistory.com/470713 )
( 예제: 기울기 = –k https://ywpop.tistory.com/470705 )
( 참고: 1차 반응 https://ywpop.tistory.com/26 )
▶ 2차 반응 (실험 data 및 그래프)
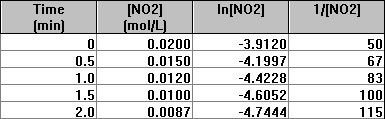

---> 양의 기울기, 즉 오른쪽 위로 직선이 그려지므로,
2차 반응.
---> 2차 반응의 속도 상수, k = 기울기
( 예제: 기울기 = k https://ywpop.tistory.com/470611 )
( 참고: 2차 반응 https://ywpop.tistory.com/25 )
[ 관련 글 https://ywpop.blogspot.com/2024/07/225-no2g-cog-nog-co2g-270104-s-no2.html ]
The rate of the reaction NO2(g) + CO(g) → NO(g) + CO2(g) depends only on the concentration of nitrogen dioxide below 225℃. At a temperature below 225℃, the following data were collected: Determine the rate law, the integrated rate law, and the value of the rate constant. Calculate [NO2] at 2.70×10^4 s after the start of the reaction.


[ 관련 글 https://ywpop.blogspot.com/2024/07/second-order-rate-constant.html ]
N2O 분자가 분해되어 질소 분자와 산소 원자로 되는 2차 반응의 속도 상수를 서로 다른 온도에서 측정한 결과는 다음과 같다. 이 반응의 활성화 에너지를 그래프를 이용해 구하라.

[키워드] 1차 반응 2차 반응 기준, 반응차수 그래프법 기준, 반응차수 그래프법 사전, 반응속도 그래프법 기준, 반응속도 그래프법 사전
'일반화학 > [14장] 화학반응 속도론' 카테고리의 다른 글
| Arrhenius(아레니우스) 식. 속도 상수와 활성화 에너지 (1) | 2015.10.26 |
|---|---|
| 실험 자료로부터 속도 법칙 구하기. 초기 속도법 (0) | 2015.07.03 |
| [화학 반응 속도] 시계 반응 실험 ★ (0) | 2014.07.11 |
| 반응 속도. reaction rate. 평균 반응 속도 ★ (7) | 2014.07.08 |
| 활성화 에너지 (activation energy, Ea) (0) | 2012.07.02 |
| 반응 차수. 2차 반응 (second order rxn) ★ (0) | 2012.06.29 |
| 반응 차수. 1차 반응 (first order rxn) ★ (0) | 2012.06.28 |
| 속도 법칙(rate law)과 반응 차수(reaction order) ☆ (0) | 2012.06.27 |




댓글