속도 법칙(rate law)과 반응 차수(reaction order)
---------------------------------------------------
▶ 참고: 제14장 화학 반응 속도론. 목차
[ https://ywpop.tistory.com/12739 ]
---------------------------------------------------
지난 시간에 정의한 반응 속도는 ‘평균값’임을 알고 있다.
( 참고 https://ywpop.tistory.com/2668 )
따라서 반응이 일어나는 동안 특정 시간 영역(구간),
가령, 5초~15초, 10초~30초를 선택하여,
그 때의 반응물(생성물) 농도를 측정하면,
반응 속도를 구할 수 있다.
그런데, 대부분의 화학 반응은
반응 초반부에 거의 전부 다 일어나 버린다.
그것도 아주 빠르게...
이것은 짝짓기 게임에 비유할 수 있다.
여기 앉아있는 학생들, 박수 1번, 3번, 5번(짝짝 짝짝짝) 하다가,
사회자가 갑자기 “5명씩 짝짓기”라고 외치면,
대부분 짧은 시간 내에 5명씩 짝을 짓고
게임이 끝나는 상황과 비슷하다.
이 때문에, 반응이 진행됨에 따라
① 반응물(생성물)의 농도 변화량이 작기 때문에,
농도 차이를 정확히 측정하는 것이 어렵다.
② 역반응이 일어날 수 있기 때문에,
농도 측정에 오차가 발생할 수 있다.
---> ‘초기’ 반응 속도 측정.
[보충 설명]
같은 10초 구간이라도,
반응 시작 후, 10초와 20초 사이의 농도 변화량은
반응 시작 후, 30초와 40초 사이의 농도 변화량보다
훨씬 크다.
[1] 속도 법칙. rate law
> 반응 속도를
속도 상수와 반응물의 농도(초기 농도)로 나타낸 식
다음 반응, aA + bB → cC + dD 에 대한 속도 법칙은

여기서 k(속도 상수), x, y는 반드시 실험을 통해 결정해야 한다.
이론적으로 계산 불가. (아주 중요)

[참고] 반응 속도에서의 속도와 속도 법칙에서의 속도
반응 속도에서의 속도는 이론적인 속도이고,
속도 법칙에서의 속도는 그 이론적인 속도의 원리(정의)를 이용하여
실제로 실험을 통해 측정한 속도이다.
즉, 반응물의 처음 농도를 변화시키면서 측정한 속도이다.
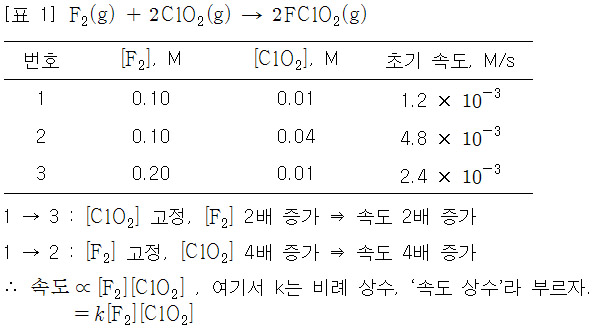
[표 1]에서, 반응물인 [F2] 또는 [ClO2]의 초기 농도를 달리하면서
각각의 반응에 대해 속도를 측정하였는데,
여기서 나타낸 속도는 시간에 따른 반응물의 농도 감소량 또는
생성물의 농도 증가량을 측정한 것이다.
반응 속도에서는 반응물로 속도식을 나타낼 때 (–) 부호를 붙인 반면,
속도 법칙에서 반응물로 속도식을 나타낼 때
(–) 부호를 붙이지 않은 이유(차이)가
위와 같이 두 속도의 성격이 다르기 때문이다.
[2] 반응 차수. reaction order
> 속도 법칙에 나타낸 모든 반응물 농도의 지수항의 합

> 반응 차수는 반드시 실험을 통해 결정해야 한다.
[참고] 속도 법칙에서 지수항인 x 및 y는
화학량론 계수와는 무관하다.
---> 반응 차수는 반드시 실험을 통해 결정.

[ 관련 글 https://ywpop.blogspot.com/2025/12/cog-cl2g-cocl2g.html ]
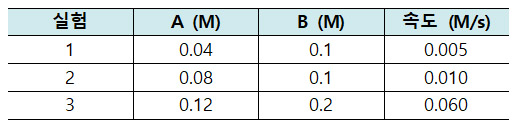
염화 카보닐(COCl2, 포스젠 phosgene)은 다양한 유기 화합물의 합성에 사용되지만, 매우 유독한 기체이다. 염화 카보닐을 만드는 CO(g) + Cl2(g) → COCl2(g) 반응을 어떤 온도에서 수행한 다음 실험 데이터를 이용해서 속도 법칙을 쓰고, k_r의 값을 구하시오.
[ 관련 글 https://ywpop.blogspot.com/2024/08/rate-law-and-reaction-order.html ]
속도 법칙 구하는 방법/순서. 반응 차수 결정하는 방법
[ 관련 예제 https://ywpop.tistory.com/24540 ] A + 2B → C 반응에서 초기 반응 속도
[ 관련 예제 https://ywpop.tistory.com/4122 ] 속도법칙과 속도상수 구하기
[ 관련 예제 https://ywpop.tistory.com/8429 ] 반응차수 구하기
[ 관련 글 https://ywpop.blogspot.com/2024/07/a-b-reaction-order.html ]
A와 B에 대한 반응 차수 reaction order
[ 이어지는 글 https://ywpop.tistory.com/26 ] 반응 차수. 1차 반응
[키워드] 속도 법칙 기준, 반응 차수 기준, 속도 법칙 사전, 반응 차수 사전
'일반화학 > [14장] 화학반응 속도론' 카테고리의 다른 글
| Arrhenius(아레니우스) 식. 속도 상수와 활성화 에너지 (1) | 2015.10.26 |
|---|---|
| 실험 자료로부터 속도 법칙 구하기. 초기 속도법 (0) | 2015.07.03 |
| [화학 반응 속도] 시계 반응 실험 ★ (0) | 2014.07.11 |
| 반응 속도. reaction rate. 평균 반응 속도 ★ (7) | 2014.07.08 |
| 활성화 에너지 (activation energy, Ea) (0) | 2012.07.02 |
| 반응 차수. 그래프를 이용한 1차와 2차 반응의 구별법 (0) | 2012.06.30 |
| 반응 차수. 2차 반응 (second order rxn) ★ (0) | 2012.06.29 |
| 반응 차수. 1차 반응 (first order rxn) ★ (0) | 2012.06.28 |




댓글