산화-환원 적정. 비타민 C 정량분석 (실험 이론)
산화-환원 적정을 이용하여
시중에 유통되고 있는 비타민 드링크제에 포함된
비타민 C의 함량을 분석해 보자.


> Potassium iodide. KI. 아이오딘화 칼륨
> Potassium iodate. KIO3. 요오드산 칼륨
산 촉매를 넣기 전 KI + KIO3 혼합 용액의 색깔은 투명(무색).
즉, KI와 KIO3만 있을 때는 서로 반응하지 않는다.
산 촉매를 넣으면, KI와 KIO3가 반응하여 그 결과 I2가 생성된다.
생성된 I2 때문에 용액의 색깔은 무색에서 검붉은 색(검보라색)으로 변한다.

[ KIO3 + KI + 산촉매 ]
IO3^- + 5I^- + 6H^+ → 3I2 + 3H2O
( 참고: redox IO3^- + I^- → I2 https://ywpop.tistory.com/16617 )
※ I2 표준용액을 만들 때,
I2를 직접 사용하지 않고 KI와 KIO3를 사용하는 이유
---> I2는 무극성 분자성 화합물이므로,
물에 거의 용해되지 않기 때문이다.
---> Elemental iodine is slightly soluble in water,
with 1 g dissolving in 3450 mL at 20℃.
---> I2로는 적정에 필요한 농도로 용액을 제조할 수 없다.

> I2에 의해 C6H8O6(ascorbic acid)가 산화된다.
> C6H8O6가 산화되고, I2가 환원된다.
I2 + C6H8O6 → C6H6O6 + 2I^- + 2H^+
I2(aq) + C6H8O6(aq) → C6H6O6(aq) + 2I^-(aq) + 2H^+(aq)
> I의 산화수는 0에서 –1로 감소, I2는 I^-로 환원됨. I2는 산화제.
> C의 산화수는 +4/6에서 +1로 증가, C6H8O6는 C6H6O6로 산화됨.
( 참고: C의 산화수 https://ywpop.tistory.com/10241 )

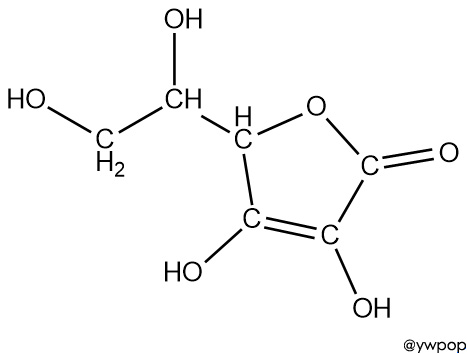
[그림] Vitamin C (ascorbic acid) 의 구조식.

IO3^- + 3C6H8O6 → 3C6H6O6* + I^- + 3H2O
IO3^- : C6H8O6 = 1 : 3 계수비(= 몰수비)
IO3^- : C6H8O6 = 1 : 3 mol비로 반응.
[ 관련 예제 https://ywpop.tistory.com/10968 ] 14.42 mL of 0.008332 M KIO3 + C6H8O6

녹말지시약 ( 제조 방법 https://ywpop.tistory.com/4237 ).
용액 안에 비타민 C와 녹말이 함께 있을 경우,
I2는 비타민 C하고만 선택적으로 먼저 반응한다.
모든 비타민 C가 산화되어 더 이상 존재하지 않으면,
이때 비로소 I2는 녹말과 반응하여 I2-녹말 착물을 형성하는데,
이 착물의 색깔이 청색을 띠기 때문에,
산화-환원 적정의 종말점을 확인할 수 있다.
이 때문에 비타민 C 산화-환원 적정 실험에
녹말을 지시약을 사용하는 것이다.

I2 + I^- → I3^-
I3^- + starch → dark blue complex
녹말이 생체고분자라 녹말지시약 반응식은 이렇게 밖에 쓸 수 없다.
착물의 입체 구조는 구글에서 “starch iodine complex”로 검색.
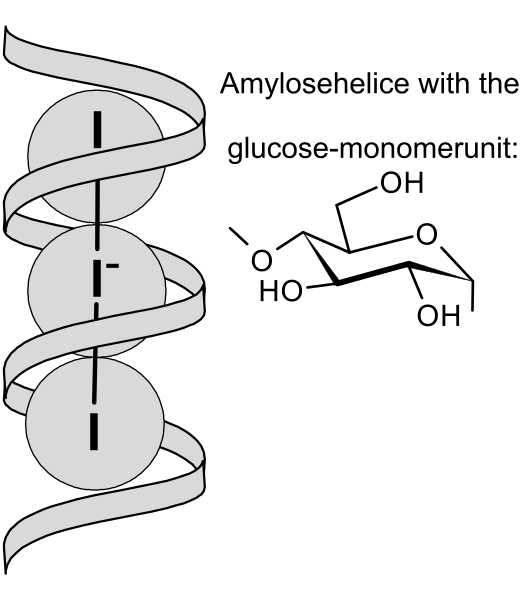
[ 그림 출처 wikimedia ] Schematic view of I3^- ions embedded in amylose helix.

[ 그림 출처 wikimedia ] Ballpoint pen coil spring.
[참고] 표준용액의 제조방법을 보면,
표준용액의 농도는 KIO3의 몰농도로 제조한다.
이 때문에 ‘KIO3 표준용액’이라 명명하기도 하지만,
녹말 검출용 시약으로서의 공식적인 이 용액의 이름은
요오드-요오드화칼륨 용액 또는
아이오딘-아이오딘화칼륨(iodine-potassium iodide) 용액이다.
[참고] Lugol’s iodine. 아이오딘-아이오딘화 칼륨
[ https://en.wikipedia.org/wiki/Lugol%27s_iodine ]
[ https://ko.wikipedia.org/wiki/아이오딘-아이오딘화_칼륨 ]
[ 관련 글: 요오드-요오드화칼륨 표준용액 제조방법 https://ywpop.tistory.com/6000 ]
[ 관련 글: 비타민 드링크제 희석 용액 250 mL 만들기 https://ywpop.tistory.com/9379 ]
[ 관련 글 https://ywpop.tistory.com/19874 ] 비타민 C 정량 분석할 때 산-염기 적정이 아닌 산화-환원 적정을 이용하는 이유
[이어지는 글 https://ywpop.tistory.com/17697 ] 비타민 C 정량분석 (실험 방법 및 결과)
[참고] 종말점에서 청색으로 변하는 이유
I2와 녹말이 만나면 I2-녹말 착물이 생성되는데,
이 착물의 색깔이 청색이기 때문입니다.
[참고] (가열하면) 녹말의 구조가 느슨해진다.
---> 링 모양의 스프링을 생각해보세요.
그 스프링이 온도에 의해 약간 늘어났다고 보면 됩니다.
[키워드] 요오드와 녹말의 반응식, 요오드와 녹말지시약의 반응식, KI + KIO3, 비타민 C 정량 기준문서, 비타민 C 적정 기준문서, 비타민 C 사전, 비타민 C 기준문서, 비타민 C dic, 비타민 C 적정 사전, 비타민 C 정량분석 기준문서, 비타민 C 정량분석 사전

[Google 검색 실적] Medal of Honor
'화학' 카테고리의 다른 글
| 산과 암모니아의 반응 (0) | 2017.11.05 |
|---|---|
| 프레온-113 기체의 실험식. C2F3Cl3 (0) | 2017.11.05 |
| 열용량과 비열. 100 g을 10℃에서 70℃로 온도를 상승 (0) | 2017.11.05 |
| 유효 핵전하와 원자가 전자가 느끼는 유효 핵전하가 같은 말인가요 (1) | 2017.11.04 |
| 이온화합물을 형성하는 다음 화학반응식을 완성하시오 (0) | 2017.11.04 |
| Na2SO4로 sulfate(SO4^2-) 표준용액 100 ppm 만들기 (2) | 2017.11.03 |
| 알짜이온반응식. HNO2 + NaOH (0) | 2017.11.03 |
| 기체법칙의 변신. P / T = P’ / T’ (3) | 2017.11.02 |
댓글