gas-phase reaction at 290℃ ClCO2CCl3(g) → 2COCl2(g)
The following gas-phase reaction was studied at 290℃ by observing the change in pressure as a function of time in a constant-volume vessel.
ClCO2CCl3(g) → 2COCl2(g)
Determine the order of the reaction and the rate constant based on the following data, Where P is the total pressure.
Time = 0 s → P = 15.76 mmHg
Time = 181 s → P = 18.88 mmHg
Time = 513 s → P = 22.79 mmHg
Time = 1164 s → P = 27.08 mmHg
일정한 부피와 290℃에서 기체 상태에서 진행되는 다음 반응의 시간에 따른 압력 변화를 관찰하였다.
ClCO2CCl3(g) → 2COCl2(g)
다음 자료를 기초로 하여 반응 차수와 속도 상수를 구하라.
여기서 P는 전체 압력이다.
[참고] 1차 반응
[ https://ywpop.tistory.com/26 ]
[참고] 2차 반응
[ https://ywpop.tistory.com/25 ]
※ 여기서 P는 전체 압력
( Where P is the total pressure )
---> 이것이 이 문제의 핵심이다.
t = t 에서, ICE 도표를 작성하면,
.............. ClCO2CCl3(g) → 2COCl2(g)
초기(t=0): P_0 ... 0
변화(t=t): –x ... +2x
평형(t=t): (P_0 – x) ... 2x
t = t 에서,
전체 압력 = (P_0 – x) + 2x
= P_0 + x
가령, t = 181 에서,
전체 압력 = 18.88 mmHg 이므로,
18.88 = 15.76 + x
x = 18.88 – 15.76 = 3.12 mmHg
따라서
t = 181 에서,
ClCO2CCl3의 부분 압력 = P_0 – x
= 15.76 – 3.12 = 12.64 mmHg
이런 식으로
시간에 따른 ClCO2CCl3의 부분 압력을 계산하면,
t = 0 → 15.76 mmHg
t = 181 → 15.76 – (18.88 – 15.76) = 12.64 mmHg
t = 513 → 15.76 – (22.79 – 15.76) = 8.73 mmHg
t = 1164 → 15.76 – (27.08 – 15.76) = 4.44 mmHg
[도표] 입력 자료

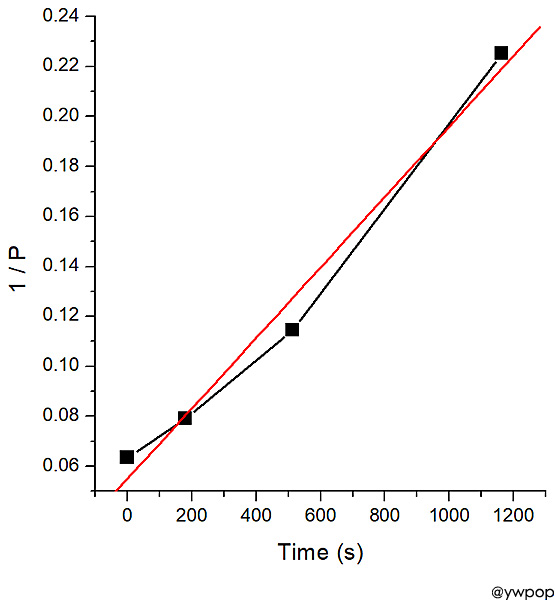
[그림] 1 / P_ClCO2CCl3 vs. Time 그래프.
직선이 아니다.
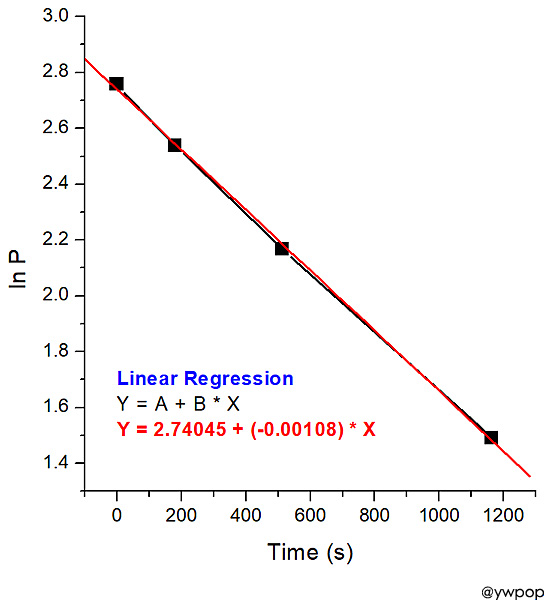
[그림] ln P_ClCO2CCl3 vs. Time 그래프.
직선이다.
---> 1차 반응이다.
선형 회귀분석. Linear Regression (빨간색 직선)
( 참고 https://ywpop.tistory.com/23521 )
Y = A + B * X
Y = 2.74045 + (–0.00108) * X
속도 상수, k = –slope 이므로,
k = –(–0.00108)
= 0.00108
= 1.08×10^(-3) /s
답: 1차 반응, k = 1.08×10^(-3) /s
[ 관련 글 https://ywpop.tistory.com/470705 ]
C2H5I(g) → C2H4(g) + HI(g) 반응 차수와 속도 상수
[키워드] 1차 반응 기준, 1차 반응 그래프 기준, 선형 회귀 분석 기준, 1차 반응 그래프 사전
'일반화학 > [14장] 화학반응 속도론' 카테고리의 다른 글
| 충돌 이론. 충돌 모형. 온도 증가 시 (2) | 2025.01.31 |
|---|---|
| 2N2O5(g) → 2N2O4(g) + O2(g) 반응의 활성화에너지 계산 (0) | 2024.10.28 |
| 화학 반응 속도의 범위. reaction rates time scales (0) | 2024.10.24 |
| 2HI(g) → H2(g) + I2(g) 410℃ 반응 차수 속도 상수 (0) | 2024.10.14 |
| C2H5I(g) → C2H4(g) + HI(g) 반응 차수와 속도 상수 (1) | 2024.10.10 |
| 물질 A가 일차 반응으로 세 번의 반감기 후 10.0 g (4) | 2024.10.09 |
| 2NO(g) + 2H2(g) → N2(g) + 2H2O(g) 6.0×10^4 M^-2 s^-1 (0) | 2024.09.21 |
| 2차 반응 적분법으로 반응 속도 구하기 (2) | 2024.08.07 |



댓글