아레니우스 식. 속도 상수의 온도 의존성
Arrhenius equation. The effect of temperature on reaction rate
아레니우스식으로 그래프 그리기
아레니우스식으로 기울기와 절편 구하기

▶ 속도 상수의 온도 의존성을 정량적으로(수식으로) 나타낸 식

▶ 반응 계(system)를 가열하면,
(1) 계를 구성하는 입자들의 운동 에너지 증가.
계속 가열하면, 결국에는 활성화에너지 이상으로 증가.
(2) 증가된 운동 에너지로 인해, 충돌 횟수 증가.
증가된 충돌 횟수만큼, 효과적인 충돌 증가.
---> 반응 속도 증가
( 참고: 충돌이론과 활성화에너지 https://ywpop.tistory.com/32 )
▶ 반응 속도는 온도가 10℃ 증가함에 따라 약 2배정도 빨라진다.
▶ k = Ae^(–Ea/RT)
---> 자주 충돌할수록(A), 활성화에너지가 낮을수록(Ea), 온도가 높을수록(T),
반응속도(k)는 증가한다. ( v ∝ k )





ln(k_2 / k_1) = Ea/R (1/T_1 – 1/T_2)
( R = 8.314 J/mol•K )
( R = 1.987 cal/mol•K )
( 참고 https://ywpop.tistory.com/7288 )
Ea = ln(k_2 / k_1) × R / (1/T_1 – 1/T_2)
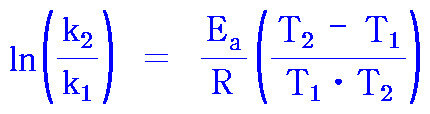
ln(k_2 / k_1) = Ea/R (1/T_1 – 1/T_2)
ln(k_2 / k_1) = Ea/R [(T_2 – T_1) / (T_1 × T_2)]
Ea = ln(k_2 / k_1) × R × [(T_1 × T_2) / (T_2 – T_1)]
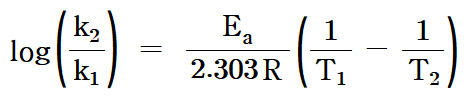

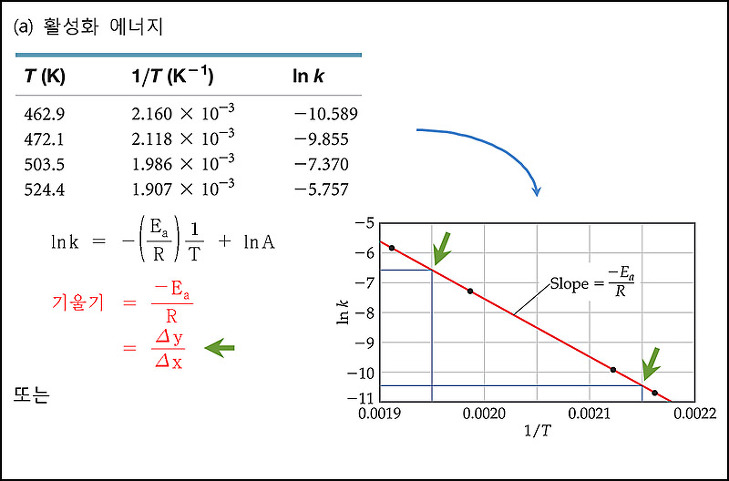
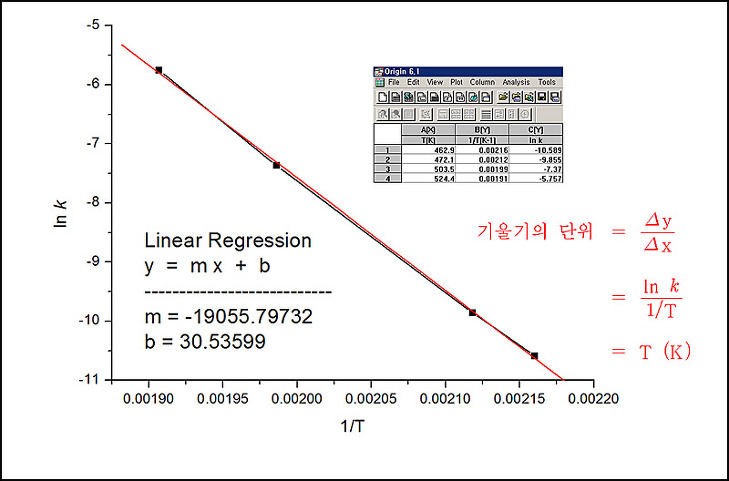
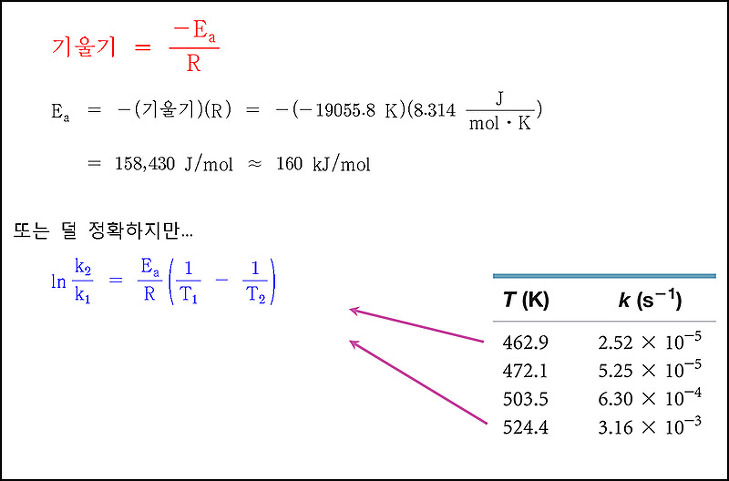
[예제] 활성화 에너지 결정.
여러 온도에서 메틸 이소니트릴의 재배열 반응(이성질체 전환 반응)
속도 상수를 측정한 실험 자료로부터, (a), (b)를 구하시오.
(a) 활성화 에너지
(b) 430 K (157℃)에서의 속도 상수
여러 온도에서의 메틸 아이소나이트릴의 자리 옮김 반응의 속도 상수
( 예제 https://ywpop.tistory.com/12494 )


[ 관련 예제 https://ywpop.tistory.com/12772 ] 어떤 반응의 속도 상수가 100℃에서 1.1×10^(-9) L/mol이며, 300℃에서 1.2×10^(-7) L/mol일 때, 이 반응의 활성화 에너지와 200℃에서 속도 상수를 구하라.
[ 관련 예제 https://ywpop.tistory.com/19842 ] 촉매 사용 반응의 활성화 에너지 계산. 37℃ 촉매 사용하였을 때 속도상수 2.50×10^3 배 증가
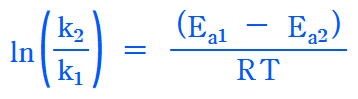
[ 관련 예제 https://ywpop.tistory.com/22381 ] 반응온도 25℃에서 35℃ 증가, 반응속도 2배. 활성화 에너지 계산
[ 관련 글 https://ywpop.tistory.com/4119 ] Arrhenius(아레니우스) 식. 속도 상수의 온도 의존성
[ 관련 글 https://ywpop.tistory.com/12739 ] 화학 반응 속도론 목차
[ 관련 글 https://ywpop.blogspot.com/2024/07/second-order-rate-constant.html ]
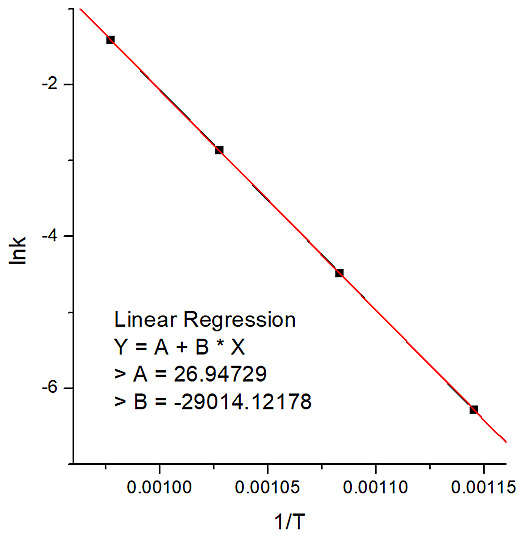
N2O 분자가 분해되어 질소 분자와 산소 원자로 되는 이차 반응의 속도 상수를 서로 다른 온도에서 측정한 결과는 다음과 같다. 이 반응의 활성화 에너지를 그래프를 이용해 구하라.
The second-order rate constant for the decomposition of nitrous oxide (N2O) into nitrogen molecule and oxygen atom has been measured at different temperatures: Determine graphically the activation energy for the reaction.
[ 관련 글 https://ywpop.tistory.com/470797 ]
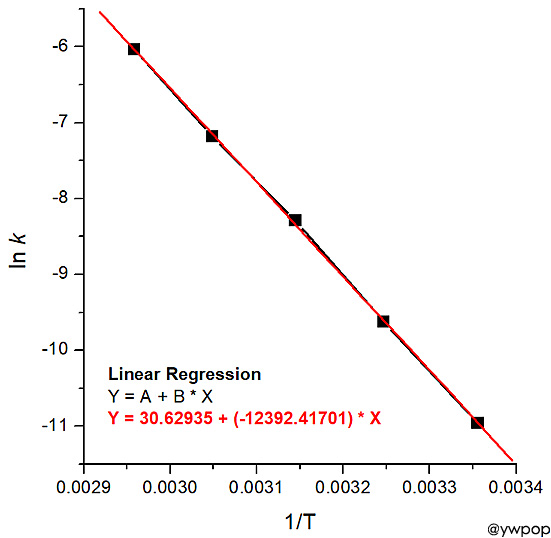
2N2O5(g) → 2N2O4(g) + O2(g) 이 반응의 활성화 에너지를 그래프를 이용하여 결정하시오.
[키워드] 아레니우스 식 기준, 속도 상수의 온도 의존성 기준, 속도 상수와 활성화 에너지 기준, 14장 화학 반응속도론-2, 활성화 에너지 사전, 아레니우스 식 사전, 속도 상수 사전, 아레니우스 사전
'일반화학 > [14장] 화학반응 속도론' 카테고리의 다른 글
| 속도법칙과 반응차수. 반응차수 구하기 (0) | 2018.01.13 |
|---|---|
| 2차 반응. 적분 속도 반응식의 유도 (1) | 2018.01.01 |
| 분자도와 단일단계 반응의 속도법칙 (1) | 2017.11.01 |
| 충돌 이론의 3가지 조건(가정) (0) | 2017.06.18 |
| 0차 반응. 0차 반응속도. 고체 표면에서의 기체 분해 반응 (0) | 2016.12.18 |
| 온도가 높아지면 왜 정반응, 역반응 속도가 동시에 빨라지게 되나요 (0) | 2016.10.04 |
| 촉매 (catalyst) ★ (0) | 2016.06.23 |
| 속도상수(k)의 온도 의존성과 활성화에너지(Ea) (2) | 2016.01.16 |



댓글