화학 반응에서 엔트로피 변화
---------------------------------------------------
▶ 참고: 제19장 화학 열역학. 목차
[ https://ywpop.tistory.com/16773 ]
---------------------------------------------------

> 표준 몰 엔트로피, 표준몰엔트로피, S°의 정의
> 등온/가역과정에 주목(주의)할 것.
> 자연에서 일어나는 과정은
즉, 실험실 비커 속에서 일어나는 반응은
거의 대부분 비가역과정이다.
( 참고 https://ywpop.tistory.com/9301 )
> 평형과 혼동할까봐 얘기하는 건데,
비가역과정을 거쳐서 평형에 도달한다.

> S는 화학식의 “원자 수”에 비례.
---> 분자를 구성하는 원자의 개수가 많을수록,
분자의 진동 운동 방식의 개수 증가.
( 참고 https://ywpop.tistory.com/5860 )
---> 엔트로피의 통계 열역학적 정의에 따라,
( 참고 https://ywpop.tistory.com/2965 )
W가 증가하므로, S는 증가.

> 열역학 제2법칙
[비가역 과정] 자발적 변화(반응)의 방향
⇨ 우주의 엔트로피를 증가시키는 방향
ΔS_우주 = ΔS_계 + ΔS_주위 > 0

> 계의 표준 엔트로피 변화 = 표준 반응 엔트로피 변화
> 계의 엔트로피 변화 = 반응 엔트로피 변화
ΔS°_rxn = [생성물들의 S°의 합] – [반응물들의 S°의 합]

ΔS 계산. N2(g) + 3H2(g) → 2NH3(g)
반응 후 기체의 몰수가 감소하므로, 계의 엔트로피는 감소할 것이다.
참고로, 이 반응은 발열반응이다. (아래 ΔH 계산 참고)

반응물, 생성물의 표준 몰 엔트로피는
핸드북 또는 일반화학 교재 부록에서 찾는다.

반응 전/후 기체의 몰수가 감소하였으므로,
즉, “반응물 기체의 몰수 > 생성물 기체의 몰수” 이므로,
---> 계의 엔트로피는 감소하였다.
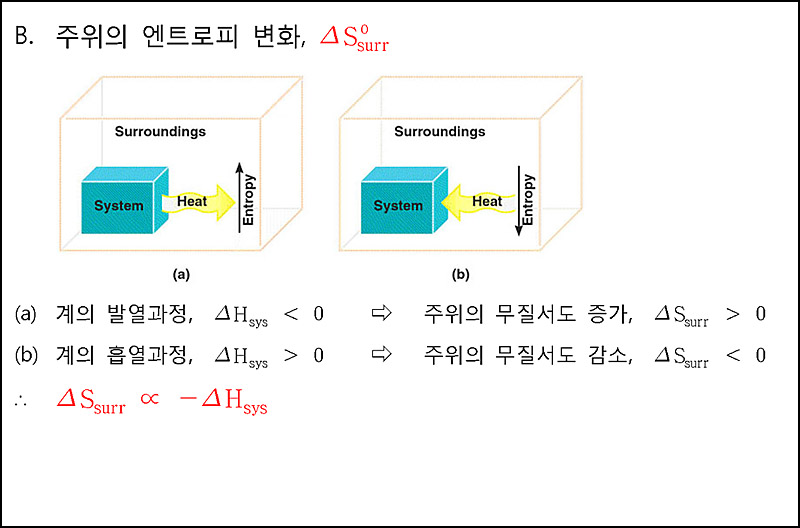
> 주위의 엔트로피 변화. ΔS°_surr
ΔS_surr ∝ –ΔH_sys

ΔS_surr = –ΔH_sys / T



우주의 엔트로피 변화. ΔS°_univ

계의 엔트로피 감소량보다 주위의 엔트로피 증가량이 더 크다.
⇨ 우주의 엔트로피가 증가하기 때문에, 이 반응은 자발적인 반응이다.
[ 관련 글 https://ywpop.tistory.com/9301 ] ΔG = ΔH – TΔS 에서 ΔS
▶ ΔH°_rxn, 반응 엔탈피 공식 [ https://ywpop.tistory.com/3431 ]
▶ ΔS°_rxn, 반응 엔트로피 공식 [ https://ywpop.tistory.com/7404 ]
▶ ΔG°_rxn, 반응 자유에너지 공식 [ https://ywpop.tistory.com/7393 ]
▶ ΔG = ΔH – TΔS 공식 [ https://ywpop.tistory.com/7438 ]
▶ ΔH, ΔS, ΔG 계산 예제 [ https://ywpop.tistory.com/16663 ]
[키워드] 반응 엔트로피 기준, 표준 몰 엔트로피 기준, 우주의 엔트로피 변화 기준, 자발적 기준, 자발성 기준, 무질서도 기준, 델타에스 계산 기준, 델타에스 기준, 반응 엔트로피 사전, 표준 몰 엔트로피 사전, 우주의 엔트로피 변화 사전, 자발적 사전, 자발성 사전, 무질서도 사전, 델타에스 계산 사전, 델타에스 사전, 표준 생성 엔트로피 기준
'일반화학 > [19장] 화학 열역학' 카테고리의 다른 글
| 자발적 과정과 엔트로피 (0) | 2018.12.11 |
|---|---|
| ΔG = ΔH – TΔS 에서 ΔS (0) | 2018.06.19 |
| 상변화 시 엔트로피 변화(ΔS). 벤젠의 끓는점 (0) | 2017.12.14 |
| Gibbs 자유 에너지 (Gibbs Free Energy) ★ (1) | 2017.07.01 |
| 표준 생성 자유 에너지와 표준 자유 에너지 변화 ★ (1) | 2017.06.22 |
| 열역학 함수 계산할 때, 절대온도를 사용하는 이유 (0) | 2015.12.14 |
| 비표준 상태에서의 자유에너지. ΔG = ΔG° + RTlnQ (0) | 2015.12.12 |
| 용해 과정에서 용액의 엔트로피 변화 (1) | 2015.10.24 |


댓글