약산의 초기농도, Ka, pH 관계식
---------------------------------------------------
▶ 참고: 약산과 산 이온화 상수, Ka
[ https://ywpop.tistory.com/15323 ]
▶ 참고: 약염기와 염기 이온화 상수, Kb
[ https://ywpop.tistory.com/15325 ]
---------------------------------------------------

① 약산 용액의 초기농도(C)
② 약산의 Ka
③ 약산 용액의 pH (= 평형에서 [H^+] = x)
---> 이들 3개 data 중에서,
2개 data가 주어지면,
Ka = x^2 / (C–x) 관계식으로부터,
나머지 1개 data의 값을 계산해낼 수 있다.
( Ka 값을 갖는 모든 약산에 100% 적용 가능 )
▶ ⓐ약산 용액과 ⓑ약염기의 짝산 용액일 경우,
Ka = x^2 / (C–x)
( 참고 https://ywpop.tistory.com/4294 )
C–x ≒ C 라 근사처리하면,
x = [Ka × C]^(1/2)
단, x = [H^+]_평형
▶ ⓐ약염기 용액과 ⓑ약산의 짝염기 용액일 경우,
Kb = x^2 / (C–x)
( 참고 https://ywpop.tistory.com/4294 )
C–x ≒ C 라 근사처리하면,
x = [Kb × C]^(1/2)
단, x = [OH^-]_평형
---------------------------------------------------
초기농도가 C인 약산의 이온화 반응식과
평형에서의 각 물질의 농도는 다음과 같다.
( 약염기의 경우에도 계산 논리는 동일하다. )
HA(aq) + H2O(l) ⇌ H3O^+(aq) + A^-(aq)
또는 간단히
HA(aq) ⇌ H^+(aq) + A^-(aq)
CH3COOH(aq) ⇌ H^+(aq) + CH3COO^-(aq)
약산의 이온화식에 대한 ICE table (ICE chart) 을 작성하면,
( ICE = Initial, Change, Equilibrium = 초기, 변화, 평형 )
( 참고 https://ywpop.tistory.com/470858 )

평형에서의 각 물질의 농도를
평형상수(산 이온화상수) 식에 대입하면 다음과 같다.

Ka = [H^+] [A^-] / [HA] = (x) (x) / (C–x)
( 약산의 초기농도(C)가 비교적 높을 경우(클 경우), )
약산의 이온화 결과 생성되는 수소 이온 농도, [H^+], 즉 x 값이 매우 작기 때문에,
( 보충설명 https://ywpop.tistory.com/2981 )
(C – x) ≒ C 라 가정하면, ( 근사적으로 처리하면, 근사처리하면, )
( 단, 5% 검증에 통과해야 된다. 참고 https://ywpop.tistory.com/5867 )

위 관계식으로부터,
① 약산의 초기농도(C)와 Ka 값을 알고 있으면, pH를 구할 수 있고,
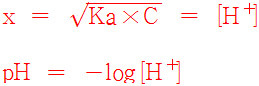
x = [Ka × C]^(1/2) = [H^+]
pH = –log[H^+]
② 약산의 초기농도(C)와 pH를 알고 있으면, Ka를 구할 수 있다.
= 약염기의 초기농도(C)와 pOH를 알고 있으면, Kb를 구할 수 있다.
( 예제: 약염기 https://ywpop.tistory.com/19165 )

pH = –log[H^+]
[H^+] = 10^(-pH) = x
Ka = x^2 / (C–x)
※ 단, Ka를 구할 때는 (C – x) ≒ C 라 근사처리하지 않아도 된다.
근의 공식을 사용할 경우가 없는, 간단한 계산이기 때문이다.
※ 단, 약산의 초기농도가 0.1 M 이상이면,
(C – x) ≒ C 라 가정하고 계산해도 된다.
예를 들어 x = 0.002 이면,
0.1 – 0.002 = 0.098 ≒ 0.1
(C – x) ≒ C 라 가정한 경우와 안 한 경우,
Ka = (0.002)^2 / 0.1 = 4.0×10^(–5) = 0.000040
Ka = (0.002)^2 / 0.098 = 4.1×10^(–5) = 0.000041
그 차이는
0.000041 – 0.000040 = 0.000001 <--- 이 정도는 무시할 수 있기 때문이다.
③ 약산의 Ka와 pH를 알고 있으면, 초기농도(C)를 구할 수 있다.
C = (x^2 / Ka) + x
( 관련 예제 https://ywpop.tistory.com/19782 )
---------------------------------------------------
약염기의 ICE 도표
( 가수분해의 경우에도 계산 논리는 동일하다. )
B(aq) + H2O(l) ⇌ BH^+(aq) + OH^-(aq)
NH3(aq) + H2O(l) ⇌ NH4^+(aq) + OH^-(aq)

Kb = [NH4^+][OH^-] / [NH3] = (x)(x) / (C–x)
※ 가수분해의 경우,
[1] 약산의 짝염기의 가수분해
CH3COO^-(aq) + H2O(l) ⇌ CH3COOH(aq) + OH^-(aq)

---> Kh = Kb = Kw / Ka
---> Kb = [CH3COOH][OH^-] / [CH3COO^-] = (x)(x) / (C–x)
[2] 약염기의 짝산의 가수분해
NH4^+(aq) + H2O(l) ⇌ NH3(aq) + H3O^+(aq)
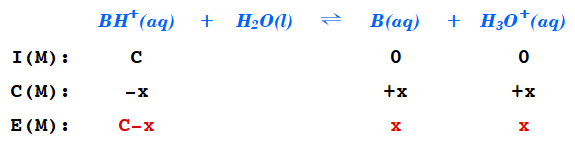
---> Kh = Ka = Kw / Kb
---> Ka = [NH3][H3O^+] / [NH4^+] = (x)(x) / (C–x)
( 참고: 가수분해 https://ywpop.tistory.com/5502 )
[ 관련 글 https://ywpop.tistory.com/11913 ] 약산의 초기농도, 이온화도, Ka의 관계
[ 관련 글 https://ywpop.tistory.com/13065 ] 약산의 Ka 값이 매우 작다는 의미
[ 관련 글 https://ywpop.tistory.com/7077 ] 평형상수식에서 용매의 농도는 상수
[ 관련 예제 https://ywpop.tistory.com/2981 ] HF, CH3COOH 용액의 pH
[ 관련 예제 https://ywpop.tistory.com/2947 ] ascorbic acid 용액의 pH
[ 관련 글 https://ywpop.tistory.com/10532 ] 시트르산 용액의 pH. 구연산 용액의 pH.
[ 관련 글 https://ywpop.tistory.com/23831 ] 약염기 용액의 pH 계산 공식
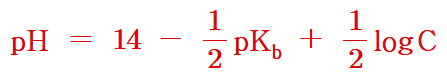
[키워드] 약산의 초기농도 기준, 약산의 평형상수 기준, 약산의 평형상수식 기준, 약산의 초기농도 사전, 약산의 평형상수 사전
'일반화학 > [16장] 산-염기 평형' 카테고리의 다른 글
| 다양성자산의 산 이온화상수 Ka, 0.065 M H2S (0) | 2015.11.28 |
|---|---|
| 다음 용액이 산성, 염기성, 중성인지 예측하시오 ★ (0) | 2015.11.21 |
| 산성, 염기성, 중성 예측. LiClO4 Na3PO4 Bi(NO3)3 NH4CN (0) | 2015.11.21 |
| 약산-약염기 염, NH4CN 용액의 pH (0) | 2015.11.21 |
| H2CO3 이온화 반응식의 ICE 도표와 Ka (0) | 2015.11.18 |
| 다양성자성 산의 이온화. Sulfurous acid, H2SO3 (1) | 2015.11.14 |
| 약산-약염기의 염 용액의 pH. 0.250 M NH4F 용액의 pH ★ (1) | 2015.11.11 |
| 약산-약염기 염 용액의 pH. 0.250 M NH4F 용액의 pH ★ (0) | 2015.11.11 |

댓글