약산의 이온화상수와 이온화도의 관계. Ka와 α의 관계
약산의 초기농도, 이온화도, 이온화상수의 관계
초기농도가 C이고 이온화도가 α인 약산의 이온화 반응식과
평형에서의 각 물질의 농도를 이온화도로 나타내면 다음과 같다.

> A^-(aq)는 약산의 짝염기 (또는 약산의 음이온)
> CH3COOH(aq) ⇌ H^+(aq) + CH3COO^-(aq)
평형에서의 각 물질의 농도를
평형상수(산 이온화상수) 식에 대입하면 다음과 같다.
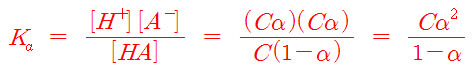
Ka = Cα^2 / (1–α)
( 참고 https://ywpop.tistory.com/11913 )
약산의 이온화도는 1보다 매우 작기 때문에,
1–α ≒ 1 이라 근사처리하면,
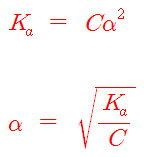
α = [Ka / C]^(1/2)
( 참고 https://ywpop.tistory.com/11913 )
[ 관련 글 https://ywpop.tistory.com/7263 ] 이온화도와 이온화백분율
[ 관련 글 https://ywpop.tistory.com/4294 ] 약산의 초기농도, Ka, pH 관계
[ 관련 글 https://ywpop.tistory.com/14364 ] HA의 이온화도가 α라면 평형에서 [H^+] = Cα 설명
[ 관련 예제 https://ywpop.tistory.com/16640 ] 0.1 M C2H5COOH 용액의 Ka. 5% 이온화.
[키워드] 약산의 이온화도와 이온화상수 기준문서, 약산의 이온화상수와 이온화도 기준문서, 약산의 해리도와 이온화상수 기준문서, 약산의 이온화상수와 해리도 기준문서, 약산의 알파와 Ka 기준문서, 약산의 Ka와 알파 기준문서, 약산의 알파와 Ka dic, 약산의 Ka와 알파 사전
'일반화학 > [16장] 산-염기 평형' 카테고리의 다른 글
| 0.020 M H2C2O4 용액의 pH와 [C2O4^2-] (0) | 2019.12.06 |
|---|---|
| HCO3^-은 양쪽성 물질 (0) | 2019.11.21 |
| HCl 용액의 pH ★ (2) | 2019.11.13 |
| NaOH 용액의 pH ★ (0) | 2019.11.13 |
| 약산의 이온화 상수 식에서 물의 농도를 상수 취급하는 이유 (0) | 2019.07.04 |
| 약산의 Ka 값이 클수록 보다 더 강산인 이유 (0) | 2019.06.13 |
| 0.0302 M 인산 용액의 pH (1) | 2019.06.01 |
| pH of 5.789 M HCl solution (0) | 2019.05.24 |


댓글