약산 ascorbic acid 용액의 pH. 250 mg / 250 mL
아스코브산(ascorbic acid, C6H8O6) 250 mg을 포함하는
비타민 C 정제를 250 mL의 물에 용해시켰다.
이 용액의 pH는 얼마인가?
(아스코브산의 Ka = 8.0×10^(-5), 몰질량 = 176 g/mol)
---------------------------------------------------
▶ 참고: 약산의 초기농도, Ka, pH 관계식
[ https://ywpop.tistory.com/4294 ]
---------------------------------------------------
[1] 아스코브산의 몰농도 계산
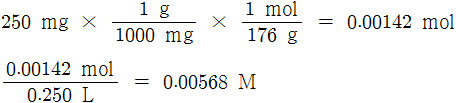
[2] 평형에서 수소 이온의 몰농도 계산
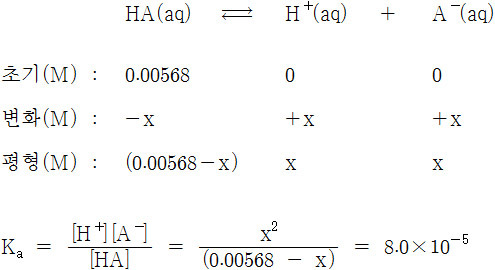
(0.00568 – x) ≒ 0.00568 이라 근사처리하면,
x = [(8.0×10^(-5)) (0.00568)]^(1/2)
= 0.0006741 M = [H^+]
근사처리가 유효하려면
x 값이 초기 농도의 5% 미만이어야 하므로,
0.00568 M × (5/100) = 0.000284 M < 0.0006741 M
---> 초기 농도의 5% 값보다 x 값이 크므로, 근사처리할 수 없다.
---> 5% 검증 통과 실패.
[참고] 만약 아스코브산의 초기 농도가 0.05 M이라면,
초기 농도의 5% 값이 x 값보다 크므로,
x = [(8.0×10^(-5)) (0.05)]^(1/2) = 0.002 M
0.05 M × (5/100) = 0.0025 M > 0.002 M
---> (C – x) ≒ C 근사처리 가능.
따라서 x는 근의 공식을 사용해서 계산해야 한다.
( 참고: 근의 공식 계산기 https://ywpop.tistory.com/3302 )
x^2 / (0.00568 – x) = 8.0×10^(-5)
x^2 = (8.0×10^(-5)) (0.00568 – x)
x^2 = (8.0×10^(-5))(0.00568) – (8.0×10^(-5))x
x^2 + (8.0×10^(-5))x – (8.0×10^(-5))(0.00568) = 0
x^2 + (8.0×10^(-5))x – (4.544×10^(-7)) = 0
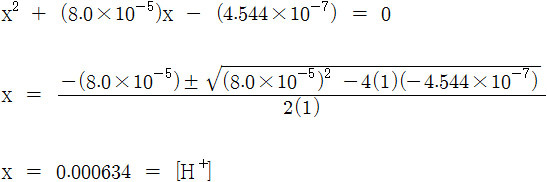
[3] 아스코브산 용액의 pH 계산

답: pH = 3.20
[ 관련 예제 https://ywpop.tistory.com/2981 ] HF, CH3COOH 용액의 pH 계산
[키워드] 비타민 C 용액의 pH 기준문서, 아스코르브산 용액의 pH 기준문서, ascorbic acid 용액의 pH 기준문서, C6H8O6 용액의 pH 기준문서, 근의 공식으로 약산 용액의 pH 계산 기준문서, 근의 공식 계산 기준문서, 근의 공식 기준문서, 근의 공식 계산 사전, 근의 공식 사전
'일반화학 > [16장] 산-염기 평형' 카테고리의 다른 글
| 다양성자성 산. 2양성자성산과 3양성자성산 (1) | 2015.06.28 |
|---|---|
| 0.1 M NH3 용액의 pH. ICE 도표로 계산 ★ (0) | 2015.06.12 |
| 크기가 작고 전하가 큰 금속 양이온과 물의 가수분해 반응 (1) | 2014.12.05 |
| 약산의 초기 농도와 Ka로부터 pH 구하기 예제 (6) | 2014.11.13 |
| 약산의 Ka와 짝염기의 Kb 사이의 관계식, conjugate acid-base pairs ★ (1) | 2014.10.30 |
| pH 11.17인 NH3 용액의 몰농도 (0) | 2014.10.16 |
| pH 값, 산도의 측정 ★ (5) | 2014.07.25 |
| 물의 자동이온화와 이온곱 상수, Kw ★ (4) | 2014.07.24 |

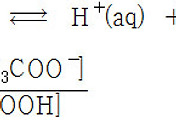

댓글