약산-약염기의 염 용액의 pH. 0.250 M NH4F 용액의 pH
[참고] 약산-약염기의 염 용액의 pH
[ https://ywpop.tistory.com/4233 ]
NH4F는 가용성 염이기 때문에,
물에서 거의 100% 이온화된다(고 가정한다).
NH4F(s) + H2O(l) → NH4^+(aq) + F^-(aq)
따라서
[NH4F] = [NH4^+] = [F^-] = 0.250 M
NH4^+는 약염기(NH3)의 짝산(비교적 강한 산)이므로,
물과 가수분해 반응이 일어난다.
NH4^+(aq) + H2O(l) ⇌ NH3(aq) + H3O^+(aq) ... ①
( 참고: 가수분해 https://ywpop.tistory.com/5502 )
Kh = Ka = Kw / Kb
= (1.0×10^(-14)) / (1.8×10^(-5))
= 5.6×10^(-10)
( Kb for NH3 = 1.8×10^(-5) )
F^-는 약산(HF)의 짝염기(비교적 강한 염기)이므로,
물과 가수분해 반응이 일어난다.
F^-(aq) + H2O(l) ⇌ HF(aq) + OH^-(aq) ... ②
Kh = Kb = Kw / Ka
= (1.0×10^(-14)) / (7.1×10^(-4))
= 1.4×10^(–11)
( Ka for HF = 7.1×10^(-4) )
※ 약산-약염기의 염 용액의 pH는
약산과 약염기의 상대적 세기에 따라 용액의 pH가 결정된다.
---> Ka / Kb, 이렇게 계산해서 어느 것이 더 센지 비교해보자.
---> 또는 Ka / Kb, 이렇게 계산해서 [H^+]에 대해 정리해보자.
①, ② 반응의 평형상수 식을 작성하면,
Ka(NH4^+) = [NH3] [H^+] / [NH4^+]
Kb(F^-) = [HF] [OH^-] / [F^-]
Kw = [H^+] [OH^-]
[OH^-] = Kw / [H^+]
Ka(NH4^+) / Kb(F^-) 식을 써보면,

위 식을 정리하면,
Ka(NH4^+) / Kb(F^-)
= ([NH3] [F^-] [H^+]^2) / (Kw × [NH4^+] [HF])
[H^+]^2 = (Kw × Ka(NH4^+) [NH4^+] [HF]) / (Kb(F^-) [NH3] [F^-])
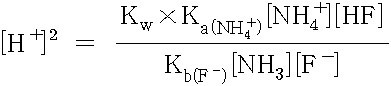
[NH4^+] = [F^-] = 0.250 M
---> 소거 (cancel out)
[NH3] = [HF] = x
---> 가수분해 결과 생성되는 양이 매우 작기 때문에 무시하면,
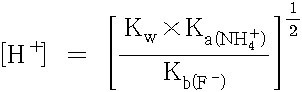
[H^+] = [ Kw × Ka(NH4^+) / Kb(F^-) ]^(1/2) ... ③
= [ [(1.0×10^(-14)) (5.6×10^(-10))] / (1.4×10^(-11)) ]^(1/2)
= 6.3×10^(-7) M
pH = –log[H^+]
= –log(6.3×10^(–7)) = 6.2
③ 식의 양변에 –log를 취하고, 정리하면,
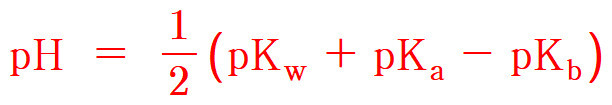
pH = 1/2 (pKw + pKa – pKb)
---> 약산-약염기의 염 용액의 pH 계산 공식
> Ka(NH4^+) = 5.6×10^(-10)
> pKa = –log(5.6×10^(-10)) = 9.25
> Kb(F^-) = 1.4×10^(-11)
> pKb = –log(1.4×10^(-11)) = 10.85
pH = 1/2 (pKw + pKa – pKb)
= (14.00 + 9.25 – 10.85) / 2
= 6.2
[참고]
> Ka for HF = 7.1×10^(-4)
> pKa = –log(7.1×10^(-4)) = 3.15
> Kb for NH3 = 1.8×10^(-5)
> pKb = –log(1.8×10^(-5)) = 4.74
pH = (14.00 + 3.15 – 4.74) / 2
= 6.2
[키워드] 약산-약염기의 염 용액의 pH 기준, NH4F 기준, 약산-약염기의 염 기준
[수정] [24/10/25]
'일반화학 > [16장] 산-염기 평형' 카테고리의 다른 글
| 약산-약염기 염, NH4CN 용액의 pH (0) | 2015.11.21 |
|---|---|
| 약산의 초기농도, Ka, pH 관계식 ★ (3) | 2015.11.19 |
| H2CO3 이온화 반응식의 ICE 도표와 Ka (0) | 2015.11.18 |
| 다양성자성 산의 이온화. Sulfurous acid, H2SO3 (1) | 2015.11.14 |
| 약산-약염기 염 용액의 pH. 0.250 M NH4F 용액의 pH ★ (0) | 2015.11.11 |
| 10^–7 M HCl, 10^–8 M HCl과 같은 묽은 염산의 pH ★ (7) | 2015.11.09 |
| 탄산나트륨(sodium carbonate, Na2CO3)의 노르말농도(normality) (0) | 2015.10.22 |
| 약산의 산 이온화상수(산 해리상수), Ka와 pKa (0) | 2015.10.21 |



댓글