[도표] 표준환원전위, standard reduction potentials, E°_red(V)
---------------------------------------------------
▶ 참고: 제20장 전기화학. 목차
[ https://ywpop.tistory.com/11389 ]
---------------------------------------------------
▶ 표준환원전위의 정의/개념
> 물질이 환원되려는 경향성의 척도
( 참고: 표준수소전극 https://ywpop.tistory.com/8305 )
예) F2 + 2e^- → 2F^- ... E° = +2.87 V
---> F2가 전자를 얻어서 F^-로 환원되고 싶어하는
욕구(desire)의 척도는 +2.87 V.
▶ 2개의 반쪽 전극으로 전지를 구성하면,
표준환원전위 값이 더 큰 물질이 환원된다.
( 표준환원전위 값이 더 큰 물질이 환원전극이 된다. )
( F2는 무조건, 100% 환원된다. )

▶ 표준환원전위 값이 클수록, 강한 산화제.
( F2는 가장 강력한 산화제. )
( 참고: 산화제와 환원제 https://ywpop.tistory.com/7783 )
▶ 표준환원전위가 큰 물질일수록 환원되기 쉽고,
표준환원전위가 작은 물질일수록 산화되기 쉽다.
( 참고: 표준환원전위와 표준산화전위 https://ywpop.tistory.com/4178 )
F2 + 2e^- → 2F^- ... E° = +2.87 V
Ag^2+ + e^- → Ag^+ ... E° = +1.99 V
Co^3+ + e^- → Co^2+ ... E° = +1.82 V
H2O2 + 2H^+ + 2e^- → 2H2O ... E° = +1.78 V
Ce^4+ + e^- → Ce^3+ ... E° = +1.70 V
PbO2 + 4H^+ SO4^2- + 2e^- → PbSO4 + 2H2O ... E° = +1.69 V
MnO4^- + 4H^+ + 3e^- → MnO2 + 2H2O ... E° = +1.68 V
2e^- + 2H^+ + IO4^- → IO3^- + H2O ... E° = +1.60 V
MnO4^- + 8H^+ + 5e^- → Mn^2+ + 4H2O ... E° = +1.51 V
Au^3+ + 3e^- → Au ... E° = +1.50 V
PbO2 + 4H^+ + 2e^- → Pb^2+ + 2H2O ... E° = +1.46 V
Cl2 + 2e^- → 2Cl^- ... E° = +1.36 V
Cr2O7^2- + 14H^+ + 6e^- → 2Cr^3+ + 7H2O ... E° = +1.33 V
O2 + 4H^+ 4e^- → 2H2O ... E° = +1.23 V
MnO2 + 4H^+ + 2e^- → Mn^2+ + 2H2O ... E° = +1.21 V
IO3^- + 6H^+ + 5e^- → 1/2 I2 + 3H2O ... E° = +1.20 V
Br2 + 2e^- → 2Br^- ... E° = +1.09 V
VO2^+ + 2H^+ + e^- → VO^2+ + H2O ... E° = +1.00 V
AuCl4^- + 3e^- → Au + 4Cl^- ... E° = +0.99 V
NO3^- + 4H^+ + 3e^- → NO + 2H2O ... E° = +0.96 V
ClO2 + e^- → ClO2^- ... E° = +0.954 V
2Hg^2+ + 2e^- → Hg2^2+ ... E° = +0.91 V
Ag^+ + e^- → Ag ... E° = +0.80 V
Hg2^2+ + 2e^- → 2Hg ... E° = +0.80 V
Fe^3+ + e^- → Fe^2+ ... E° = +0.77 V
O2 + 2H^+ + 2e^- → H2O2 ... E° = +0.68 V
MnO4^- + e^- → MnO4^2- ... E° = +0.56 V
I2 + 2e^- → 2I^- ... E° = +0.54 V
Cu^+ + e^- → Cu ... E° = +0.52 V
O2 + 2H2O + 4e^- → 4OH^- ... E° = +0.40 V
Cu^2+ + 2e^- → Cu ... E° = +0.34 V
Hg2Cl2 + 2e^- → 2Hg + 2Cl^- ... E° = +0.34 V
AgCl + e^- → Ag + Cl^- ... E° = +0.22 V
SO4^2- + 4H^+ + 2e^- → H2SO3 + H2O ... E° = +0.20 V
Cu^2+ + e^- → Cu^+ ... E° = +0.16 V
Sn^4+ + 2e^- → Sn^2+ ... E° = +0.15 V
2H^+ + 2e^- → H2 ... E° = 0.00 V
Fe^3+ + 3e^- → Fe ... E° = –0.036 V
Pb^2+ + 2e^- → Pb ... E° = –0.13 V
Sn^2+ + 2e^- → Sn ... E° = –0.14 V
Ni^2+ + 2e^- → Ni ... E° = –0.23 V
PbSO4 + 2e^- → Pb + SO4^2- ... E° = –0.35 V
Cd^2+ + 2e^- → Cd ... E° = –0.40 V
Fe^2+ + 2e^- → Fe ... E° = –0.44 V
Cr^3+ + e^- → Cr^2+ ... E° = –0.50 V
Cr^3+ + 3e^- → Cr ... E° = –0.73 V
Zn^2+ + 2e^- → Zn ... E° = –0.76 V
2H2O + 2e^- → H2 + 2OH^- ... E° = –0.83 V
Mn^2+ + 2e^- → Mn ... E° = –1.18 V
Al^3+ + 3e^- → Al ... E° = –1.66 V
H2 + 2e^- → 2H^- ... E° = –2.23 V
Mg^2+ + 2e^- → Mg ... E° = –2.37 V
La^3+ + 3e^- → La ... E° = –2.37 V
Na^+ + e^- → Na ... E° = –2.71 V
Ca^2+ + 2e^- → Ca ... E° = –2.76 V
Ba^2+ + 2e^- → Ba ... E° = –2.90 V
K^+ + e^- → K ... E° = –2.92 V
Li^+ + e^- → Li ... E° = –3.05 V
[ 관련 자료 en.wikipedia.org ] standard electrode potential
[ 관련 글 https://ywpop.tistory.com/4558 ] 볼타 전지의 표준 기전력
E°_cell = E°_red(환원전극) – E°_red(산화전극)
= (환원된 물질의 표준환원전위) – (산화된 물질의 표준환원전위)
[ 관련 글 https://ywpop.tistory.com/3195 ] 금속의 활동도 계열
[ 관련 글 https://ywpop.blogspot.com/2024/07/oxidizing-ability-and-reducing-ability.html ]
oxidizing power and reducing power. 산화력 환원력. 산화능 환원능
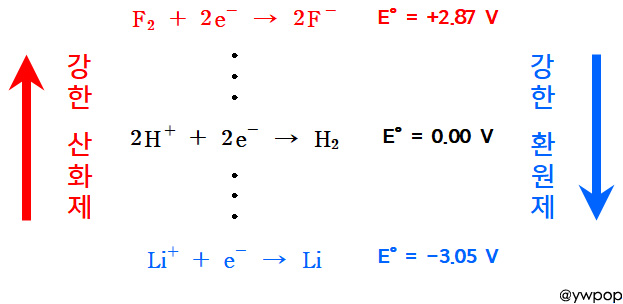
[키워드] 표준 환원 전위 도표 기준문서, 표준 환원 전위 기준문서, 표준 환원 전위 도표 사전, 표준 환원 전위 사전
'일반화학 > [20장] 전기화학' 카테고리의 다른 글
| redox balance. Fe^2+ + MnO4^- → Fe^3+ + Mn^2+ (acidic) (0) | 2017.06.13 |
|---|---|
| redox balance. Cr2O7^2- + C2H5OH → Cr^3+ + CO2 + H2O (acidic) (0) | 2017.06.12 |
| redox balance. PbO2 + Cl^- → PbCl2 + O2 (acidic) (0) | 2017.05.12 |
| redox balance. Fe^2+ + Cr2O7^2- → Fe^3+ + Cr^3+ (acidic) (0) | 2017.05.03 |
| 전기분해의 화학량론. CuSO4 수용액 3.2 A 45분 (0) | 2017.04.28 |
| redox balance. MnO4^- + NO2^- → Mn^2+ + NO3^- (acidic) (0) | 2017.04.24 |
| redox balance. Cu + NO3^- → Cu^2+ + NO (acidic) (basic) (0) | 2017.04.14 |
| redox balance. Sn^2+ + MnO4^- → Mn^2+ + Sn^4+ (acidic) (0) | 2017.02.13 |
댓글