0.1 M 황산 용액의 pH
0.1 M H2SO4 용액의 pH
황산은 2가산이므로,
다단계(2단계)로 이온화된다.
황산의 1단계 이온화 반응식
H2SO4(aq) → H^+(aq) + HSO4^-(aq)
황산은 강산이므로,
1단계는 100% 이온화된다고 가정(간주)한다.
[H2SO4] = [H^+] = [HSO4^-] = 0.1 M
황산의 2단계 이온화 평형 반응식과 평형 상수
HSO4^-(aq) ⇌ H^+(aq) + SO4^2-(aq)
Ka = [H^+][SO4^2-] / [HSO4^-] = 0.012
( 2단계에서는 일부만 이온화된다. )
2단계 이온화 평형 반응식을 화학량론에 기초하여,
ICE 도표를 작성하면,
............. HSO4^-(aq) ⇌ H^+(aq) + SO4^2-(aq)
초기(M) ... 0.1 ................. 0.1 ........... 0
변화(M) ... –x .................. +x ............ +x
평형(M) ... 0.1–x ............. 0.1+x ........ x
초기 농도에서 [HSO4^-] = [H^+] = 0.1 M 인 이유는
1단계에서 이온화되어 용액 중에 이미 존재하기 때문이다.
다단계로 이온화되는 산(또는 염기)의 경우, 이점에 주의해야 한다.
근의 공식으로 x를 계산하면,
( 참고 https://ywpop.tistory.com/3302 )
Ka = (0.1+x)(x) / (0.1–x) = 0.012
0.1x + x^2 = 0.0012 – 0.012x
x^2 + 0.112x – 0.0012 = 0
x = 0.009848 M
따라서 평형에서 [H^+]는
0.1 + 0.009848 = 0.109848 M 이므로,
0.1 M H2SO4 용액의 pH는
pH = –log(0.109848) = 0.9592 가 된다.
( 참고: 0.1 M HCl 용액의 pH = 1 https://ywpop.tistory.com/12475 )
실제 0.1 M H2SO4 용액의 pH는 0.7보다는 약간 높다.
> 2개 수소 전부 100% 이온화된다고 가정하면,
pH = –log(0.2) = 0.7
---> 실험값(= 실제값)은 이 값에 더 가깝다.
> 수소 1개만 100% 이온화된다고 가정하면,
pH = –log(0.1) = 1
주목할 점은 고등학교뿐만 아니라 대학교 교재에서도
2가 이상의 강산 또는 강염기의 pH는
2단계까지 100% 이온화된다고 가정한 농도 값으로
계산한다는 것이다.
황산의 일반적인 이온화 반응식
H2SO4(aq) → 2H^+(aq) + SO4^2-(aq)
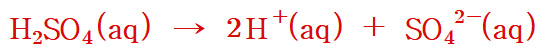
[ 관련 예제 https://ywpop.tistory.com/4927 ] 0.2 M 황산 용액의 pH
[ 관련 예제 https://ywpop.tistory.com/7201 ] 0.01 M 황산 용액의 pH
[ 관련 예제 https://ywpop.tistory.com/6666 ] 0.001 M 황산 용액의 pH
[ 관련 예제 https://ywpop.tistory.com/22878 ] 0.1 N 황산 용액 1 L의 pH
[ 관련 예제 https://ywpop.tistory.com/18008 ] 0.1 M NaHSO4 용액의 pH
[키워드] 황산 용액의 pH 기준, 황산의 pH 기준, H2SO4 용액의 pH 기준, H2SO4의 pH 기준, 황산 용액의 pH 사전, 황산의 pH 사전, H2SO4 용액의 pH 사전, H2SO4의 pH 사전, H2SO4(aq) → H^+(aq) + HSO4^-(aq) 기준, H2SO4 → H^+ + HSO4^- 기준, 황산의 이온화 기준, H2SO4의 이온화 기준, 황산의 이온화 반응식 기준, H2SO4의 이온화 반응식 기준, H2SO4 용액의 pH dic, 황산 용액의 pH dic
'일반화학 > [16장] 산-염기 평형' 카테고리의 다른 글
| 0.02 N 약산이 4% 해리되어있을 때 이 수용액의 pH는 (0) | 2016.10.25 |
|---|---|
| 1.0 M 질산 용액에서의 수소 이온(aq)의 몰농도 (2) | 2016.10.12 |
| 1.0 M HNO2 용액의 pH ★ (0) | 2016.10.04 |
| 탄산칼슘은 염기성 물질. CaCO3 basic (1) | 2016.09.30 |
| 0.050 M 포름산 (formic acid) 용액의 pH (0) | 2016.09.23 |
| 0.1 M 메틸아민(CH3NH2) 용액의 pH (0) | 2016.07.12 |
| 암모니아(약염기)와 강산의 산-염기 반응 (0) | 2016.07.11 |
| 산-염기 반응에서 가수분해 (hydrolysis) ★ (0) | 2016.06.23 |
댓글