전해전지. 전기분해의 화학량론
---------------------------------------------------
▶ 참고: 제20장 전기화학. 목차
[ https://ywpop.tistory.com/11389 ]
---------------------------------------------------
▶ 전하량(C), Q = It
> 전류, I의 단위: A
> 시간, t의 단위: sec or s
> 1 A•sec = 1 C
( 참고: 전하와 전하량 https://ywpop.tistory.com/3821 )
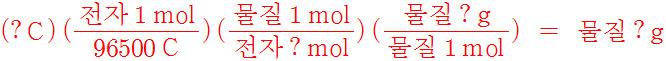

▶ 위 관계식만 이해하면,
전기분해/전기도금과 관련된 계산 문제를
대부분 간단히 해결(계산)할 수 있다.
▶ 왼쪽 식에 나오는 각 항의 단위를 소거하면, 물질의 질량만 남는다.
▶ 각 항에서 ‘?’ 기호는 다음에 해당하는 값들이다.
(전하량) (1 / Faraday 상수) (1 / 이동한 전자의 몰수) (물질의 몰질량) = 물질의 질량
▶ 따라서 4개 미지수(‘?’) 중에서 3개 값이 주어지면,
( 이동한 전자의 몰수는 반쪽 반응식으로부터 결정한다. )
나머지 1개 값을 계산할 수 있다.
▶ 1 F = 96485 C/mol ≒ 96500 C/mol
( 문제 지문에서 패러데이 상수 값이 주어지지 않았다면,
96500을 사용한다. 따라서 이 값은 외우고 있어야 된다. )
( 참고: 패러데이 상수 https://ywpop.tistory.com/2978 )
[참고] 만약 전하량이 C(쿨롱)가 아닌 F(패럿)로 주어졌다면,
(전하량) (1 / 이동한 전자의 몰수) (물질의 몰질량) = 물질의 질량
[ 관련 예제 https://ywpop.tistory.com/13087 ]
[참고]
위 식을 단순히 외우려고 하지 마세요.
환산 인자(단위소거법)를 사용해서
515 m/s 를 mi/hr 단위로 환산할 때처럼,
( 참고 https://ywpop.tistory.com/3121 )
전하량을 전자(e^-)의 mol수로, ... (? C) (1 mol e^- / 95600 C)
전자의 mol수를 물질의 mol수로, ... (1 mol e^- / 95600 C) (1 mol 물질 / ? mol e^-)
물질의 mol수를 물질의 질량으로 ... (1 mol 물질 / ? mol e^-) (? g 물질 / 1 mol 물질)
순차적으로 환산하는 것을 하나의 식으로 나타낸 것이기 때문에,
환산 인자의 개념을 이해하고 꼬리에 꼬리를 무는 순서만 숙지하면 됩니다.
> 전하량을 물질의 질량으로 환산하는 식이다.
> 즉, ‘전하량 = 물질의 질량’
> 출발은 전하량부터.
쿨롱 → 전자의 mol수 → 물질의 mol수 → 물질의 질량 순으로 환산
[ 관련 예제 https://ywpop.tistory.com/20163 ]
[사고의 발전. 창조적 사고]
1 패러데이(F)의 정의로부터,
( 참고 https://ywpop.tistory.com/5655 )
▶ 전자 1 mol = 1 F = 96500 C = 96500 A•sec
---> 이 관계로부터 계산할 수도 있다.
[ 관련 예제 https://ywpop.tistory.com/23182 ] 20%의 소금물을 전기분해하여 수산화나트륨 1몰을 얻는 데는 1 A의 전류를 몇 시간 통해야 하는가?
[ 관련 예제 https://ywpop.tistory.com/10453 ] 예제로 이해하기
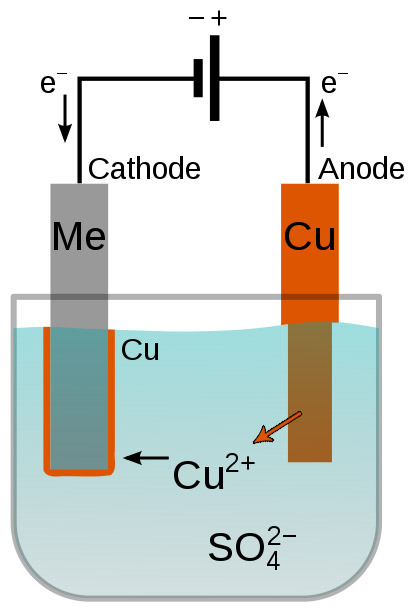
[그림] 구리 전기도금 (copper electroplating).
[ 관련 글 https://ywpop.blogspot.com/2024/07/water-electrolysis-25-782-mmhg-h2-0845.html ]
water electrolysis 25℃ 782 mmHg H2 0.845 L collected
One of the half-reactions for the electrolysis of water is 2H^+(aq) + 2e^- → H2(g) If 0.845 L of H2 is collected at 25℃ and 782 mmHg, how many moles of electrons had to pass through the solution?
물의 전기분해에서 반쪽 반응 중 하나는 다음과 같다. 2H^+(aq) + 2e^- → H2(g) 25℃, 782 mmHg에서 H2 0.845 L가 모았다면 용액을 통과한 전자의 몰수는 얼마인가?
[키워드] 전기분해 기준, 전해전지 기준, 전기분해 화학량론 기준, 전해전지 화학량론 기준, Faraday constant 기준, 전기분해 사전, 전해전지 사전, 전기분해 화학량론 사전, 전해전지 화학량론 사전, Faraday constant dic
'일반화학 > [20장] 전기화학' 카테고리의 다른 글
| 산화-환원 반응 완성하기. PbO + NH3 → Pb + N2 + H2O (0) | 2016.05.03 |
|---|---|
| 산화-환원 반응 완성하기. Cu + HNO3 → Cu(NO3)2 + NO + H2O (0) | 2016.02.17 |
| 볼타 전지의 표준 기전력, 전지 전위 ★ (1) | 2015.12.19 |
| 수소 연료 전지 (fuel cell) (1) | 2015.12.14 |
| redox balance. Cr(OH)3 + ClO^- → CrO4^2- + Cl2 (basic) (0) | 2015.12.10 |
| 비표준 상태에서 기전력. Nernst 식. 수소 기체의 압력 (2) | 2015.12.07 |
| redox balance N2H4 + NaBrO3 → N2 + Br^- (acidic) (0) | 2015.11.29 |
| 자동차 배터리, 납-산 배터리 (Lead-acid battery) (0) | 2015.11.18 |


댓글