전기도금. electroplating. Cr^3+ 7.60 A 2.00 day
[예제 1] Cr^3+(aq) 용액이 들어있는 전기도금 장치가 있다.
7.60 A의 전류를 2일 동안 흘려주었다면
도금된 Cr(s)의 질량은 얼마인가?
A Cr^3+(aq) solution is electrolyzed, using a current of 7.60 A.
What mass of Cr(s) is plated out after 2.00 days?
---------------------------------------------------
▶ 참고: 전기분해의 화학량론
[ https://ywpop.tistory.com/4461 ]
---------------------------------------------------
▶ Faraday 상수, Faraday constant, F: 전자 1몰당 전하량
> 패러데이 상수: 1 mol의 전자가 가진 전하량

전하량, Q

산화-환원 반응

산화-환원 반응에서 이동한 전자는 3 mol,
전자 1 mol당 전하량은 96,485 C (= Faraday 상수) 이므로,

[공식] 도금된 금속의 질량(g)
= 전류(A) × 시간(sec) × (1/96485) × (1 / 전자의 몰수) × 금속의 몰질량
= 7.60 × (2×24×3600) × (1/96485) × (1/3) × 52.00
= 235.93 g
[예제 2] Cr^3+(aq) 용액이 들어있는 전기도금 장치가 있다.
8.00시간 동안 0.250 mol의 Cr을 도금하기 위해서는
얼마의 전류를 흘려주어야 하는가?
How many amps are required to plate out 0.250 mol Cr
from a Cr^3+ solution in a period of 8.00 hours?
---------------------------------------------------

[예제 3] 조각가가 청동 조각에 금 도금을 부탁했다.
이온 용액 내에서 전하를 운반하는 것은 금 이온이고,
필요한 두께를 얻기 위해서는 0.5 g의 금을 용해시켜야 한다.
조각상을 3시간 동안에 도금하려면
몇 mA의 전류로 도금해야 하는가?
A sculptor has asked you
to help electroplate gold onto a brass statue.
You know that the charge carriers in the ionic solution
are singly charged gold ions,
and you’ve calculated that you must deposit 0.50 g of gold
to reach the necessary thickness.
How much current do you need, in mA,
to plate the statue in 3.0 hours?
---------------------------------------------------
도금에 사용된 금 이온이 +1가인지, +3가인지 모른다.
만약 금 이온이 +3가 이온이라고 가정하면,
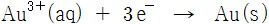

만약 금 이온이 +1가 이온이라면, 약 23 mA가 될 것이다.
( 원서에는 +1가 이온이라고 나온다. )
전류(A) = 도금된 금속의 질량(g) / [시간(sec) × (1/96485) × (1 / 전자의 몰수) × 금속의 몰질량]
= 0.5 / [(3×3600) × (1/96485) × (1/1) × 197]
= 0.0227 A
= 22.7 mA
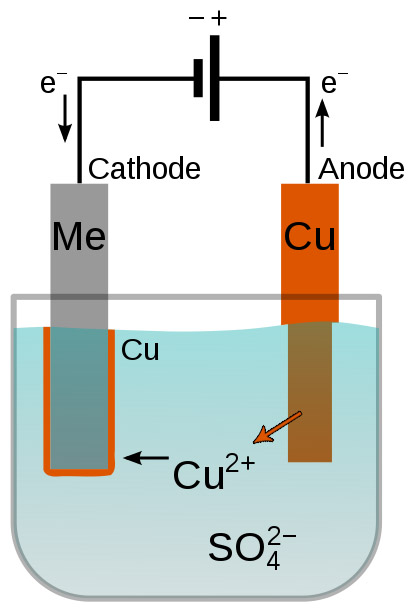
[그림] 구리 전기도금 (copper electroplating).
[키워드] 패러데이 상수 기준문서, Faraday 상수 기준문서, 95600 기준문서, 전기도금 기준문서, 전기도금 그림. 전기분해 기준문서, Cr^3+(aq) 7.60 A 2.00 day Cr(s) mass, Cr^3+(aq) 8.00 hr 0.250 mol Cr, Au^+ ion 0.50 g Au 3.0 hour mA current plate, 전기도금 사전, 크롬 도금 기준문서, Cr^3+ 도금 기준문서, 금 도금 기준문서, Au^+ 도금 기준문서
'일반화학 > [20장] 전기화학' 카테고리의 다른 글
| 볼타 전지 간단 표기법. cell diagram. cell notation (1) | 2014.12.11 |
|---|---|
| 불균등화 반응. H2O2 산화-환원 반응 (0) | 2014.12.07 |
| redox balance. Br2 → BrO3^- + Br^- (acidic) (0) | 2014.11.26 |
| 비금속과 비금속의 산화-환원 반응 (0) | 2014.11.16 |
| Nernst 식. 비표준 상태에서의 전지 전위 계산 ★ (0) | 2014.10.20 |
| 철의 부식, 철이 녹스는 것, 철의 산화 ★ (0) | 2014.10.20 |
| redox balance. Sn^2+ + NO3^- → Sn^4+ + NO (acidic) (0) | 2014.10.10 |
| 전기화학 전지 (electrochemical cell) ★ (2) | 2014.09.23 |




댓글