수소 연료 전지 (fuel cell)
▶ 연료전지에서, 연료는 수소 기체(H2 gas).
▶ 수소 연료전지는 이름 그대로,
수소를 연료로 사용해서 전기를 만드는 장치.
▶ 외부에서 수소 기체(H2)와 공기(산소, O2)를 공급하면,
산화-환원 반응에 의해 전기가 발생.
( 에너지 변환: 화학 에너지 → 전기 에너지 )
▶ 이 과정에서 물(H2O)이 생성됨.
2H2 + O2 → 2H2O
배출물이 오로지 ‘물’이기 때문에,
수소연료전지 자동차를 무공해라고 함.
▶ 수소 연료전지의 산화-환원 반응
> 산화전극 (–극): 2H2 → 4H^+ + 4e^-
> 환원전극 (+극): O2 + 4H^+ 4e^- → 2H2O
> 전체 반응: 2H2 + O2 → 2H2O
( 참고: 화학 전지 용어 정의 https://ywpop.tistory.com/8254 )

▶ 산화 반쪽 반응식
> 2H2 → 4H^+ + 4e^-
> H의 산화수는 0에서 +1로 증가, H2는 산화됨.
▶ 환원 반쪽 반응식
> O2 + 4H^+ 4e^- → 2H2O
> O의 산화수는 0에서 –2로 감소, O2는 환원됨.
▶ 전체 산화-환원 반응식
> 2H2 + O2 → 2H2O
> 산화된 물질 = H2 (H2는 환원제)
> 환원된 물질 = O2 (O2는 산화제)
[참고] 환원 반쪽 반응식의 H^+ 이온
---> H2SO4와 같은 산성 전해질 용액 속에서,
이 반응이 일어난다는 것을 의미한다.
---> 아래 연료 전지 그림에서,
Electrolyte 용액 속 이온 = H^+ 이온.
[참고] O2 환원 반응
> O + 2e^- → O^2-
> 2O + 4e^- → 2O^2-
> O2 + 4e^- → 2O^2-


[ 그림 출처 https://en.wikipedia.org/wiki/Fuel_cell ]
[ 참고 https://ywpop.blogspot.com/2023/10/hydrogen-oxygen-fuel-cell-redox.html ]
수소-산소 연료전지의 산화-환원 반응식 ( 염기성 전해질 용액 속 반응 )
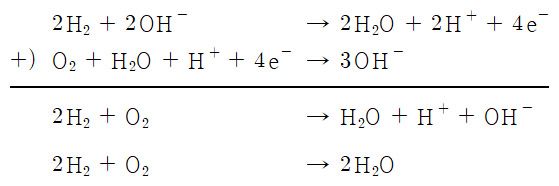
[참고] 직접 메탄올 연료 전지
> Direct methanol fuel cell. DMFC
[ 네이버 지식백과 ]
[ https://en.wikipedia.org/wiki/Direct_methanol_fuel_cell ]
[ 한글 위키백과 ]

[ 그림 출처 Wikimedia ] NASA의 Direct-methanol fuel cell.
[ 관련 글 https://ywpop.tistory.com/24097 ] 고분자전해질 연료전지. PEMFC
[ 관련 글 https://ywpop.tistory.com/4162 ] 왜 연료전지라 부르나요?
[ 관련 글 https://ywpop.tistory.com/10214 ] 연료전지의 에너지 효율이 높은 이유
[ 참고 사이트 https://www.h2news.kr/ ] 월간수소경제
[ 관련 글 https://ywpop.tistory.com/5654 ] 물의 전기분해
[키워드] 수소 연료전지 기준, 수소 연료전지 사전
'일반화학 > [20장] 전기화학' 카테고리의 다른 글
| 다니엘 전지에서 염다리의 역할 (1) | 2016.05.30 |
|---|---|
| 산화-환원 반응 완성하기. PbO + NH3 → Pb + N2 + H2O (0) | 2016.05.03 |
| 산화-환원 반응 완성하기. Cu + HNO3 → Cu(NO3)2 + NO + H2O (0) | 2016.02.17 |
| 볼타 전지의 표준 기전력, 전지 전위 ★ (1) | 2015.12.19 |
| 전해전지. 전기분해의 화학량론 ★ (0) | 2015.12.10 |
| redox balance. Cr(OH)3 + ClO^- → CrO4^2- + Cl2 (basic) (0) | 2015.12.10 |
| 비표준 상태에서 기전력. Nernst 식. 수소 기체의 압력 (2) | 2015.12.07 |
| redox balance N2H4 + NaBrO3 → N2 + Br^- (acidic) (0) | 2015.11.29 |


댓글