평균 결합 해리 에너지와 반응 엔탈피. C2H6(g) 생성 반응
결합 엔탈피로 반응 엔탈피 계산. C2H4(g) + H2(g) → C2H6(g)
에틸렌과 수소로부터 에테인(에탄)을 만드는 반응에 대한 반응열 계산
Calculate an approximate ΔH (in kJ) for the reaction
of ethylene with hydrogen to yield ethane
by using the bond dissociation energies.
Estimate the ΔH (in kJ) value for:
C2H4(g) + H2(g) → C2H6(g)

ΔH_rxn = Σ(절단 결합의 결합 엔탈피) – Σ(생성 결합의 결합 엔탈피)
= [ (C=C) + (H–H) ] – [ (C–C) + 2(C–H) ]
= [ 611 + 436 ] – [ 350 + 2(410) ]
= [ 1047 ] – [ 1170 ]
= –123 kJ
또는
위 계산은 절단되는 결합과 새로 생성되는 결합만을 고려한 계산이고,
만약 모든 결합이 절단되고 나서 모든 결합이 새로 생성된다고 생각하면,
ΔH_rxn = Σ(절단 결합의 결합 엔탈피) – Σ(생성 결합의 결합 엔탈피)
= [ (C=C) + 4(C–H) + (H–H) ] – [ (C–C) + 6(C–H) ]
= [ (611) + 4(410) + (436) ] – [ (350) + 6(410) ]
= [ 2687 ] – [ 2810 ]
= –123 kJ
---> 보통 이렇게 계산한다.
[도표] 평균 결합 에너지 (단위: kJ/mol)
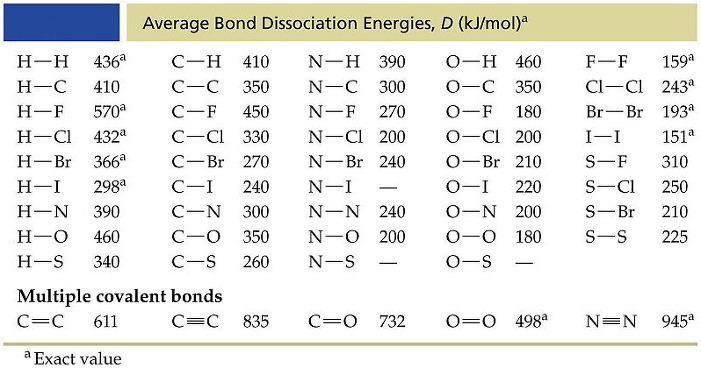
[참고] 도표에 나오는 결합 에너지 중에는
평균값이 아닌 실제값(exact value)도 몇 개 있다.
가령, H–H는 오로지 수소 분자(H2)의 결합 에너지이고,
O=O는 오로지 산소 분자(O2)의 결합 에너지이다.
그리고
C=O 결합 에너지는 실제값과 평균값, 둘 다 주어진다.
CO2의 C=O는 799 kJ/mol 이고, (실제값)
나머지 분자에서 C=O는 745 kJ/mol 이다. (평균값)
[도표] Average Bond Energies (kJ/mol)
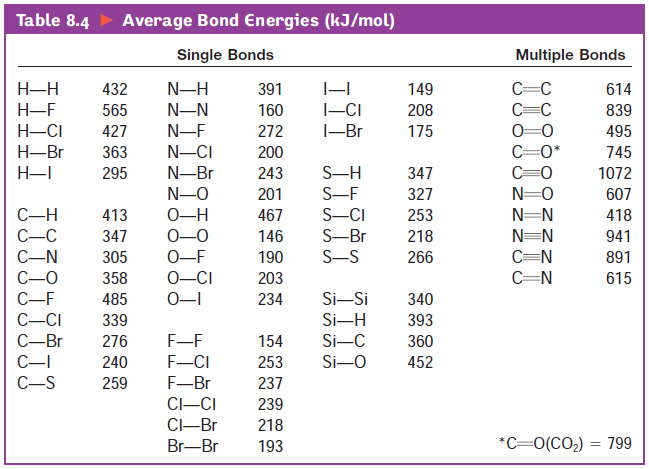
[출처] 줌달 일반화학 8판.
[참고] 발열 반응과 흡열 반응
( 참고 https://ywpop.tistory.com/5242 )
ΔH_rxn = Σ(절단 결합의 결합 엔탈피) – Σ(생성 결합의 결합 엔탈피)
= Σ(반응물의 결합 엔탈피) – Σ(생성물의 결합 엔탈피)
▶ 발열 반응: ΔH < 0
> 반응물의 결합 에너지가 생성물의 결합 에너지 보다 작다.
> 반응한 분자의 원자간 결합 에너지가
생성된 분자의 원자간 결합 에너지보다 작다.
▶ 흡열 반응: ΔH > 0
> 반응물의 결합 에너지가 생성물의 결합 에너지 보다 크다.
> 반응한 분자의 원자간 결합 에너지가
생성된 분자의 원자간 결합 에너지보다 크다.
[ 관련 예제 https://ywpop.tistory.com/4323 ] 부탄의 연소열 계산
[ 관련 글 https://ywpop.blogspot.com/2024/07/calculate-heat-of-combustion-of-heptene.html ]
헵텐의 연소열 계산
평균 결합 에너지를 사용하여 헵텐(C7H14)의 연소열을 kJ/mol 단위로 계산하시오.
Calculate heat of combustion for heptene (C7H14) in kJ/mol by using the bond dissociation energies.
[ 관련 글 https://ywpop.tistory.com/7168 ] 결합 에너지
[ 관련 글 https://ywpop.tistory.com/2558 ] 결합 에너지 도표
[ 관련 글 https://ywpop.tistory.com/13107 ] 반응 엔탈피 계산 2가지 방법
[키워드] 결합 에너지 기준, 결합 해리 에너지 기준, 결합 엔탈피 기준, 발열 반응 흡열 반응 기준, 발열 흡열 기준, 결합 에너지 사전, 결합 해리 에너지 사전, 결합 엔탈피 사전
'일반화학 > [05장] 열화학' 카테고리의 다른 글
| 155 g Cu sample 150.0℃ heat 19.8℃ water 250.0 g (0) | 2015.10.19 |
|---|---|
| 225℃ hot iron 20.0 g water 51.0 g 45.0℃ water temp rise (0) | 2015.10.19 |
| 500.0 g iron 10.0℃ water 400.0 g temp 90.0℃ rise (0) | 2015.10.15 |
| 20℃ 물 100 g과 50℃ 물 200 g의 혼합 (0) | 2015.09.24 |
| ΔH 계산. C2H6(g)의 표준생성엔탈피. 에테인의 표준생성엔탈피 (0) | 2015.06.30 |
| 25.0℃ water 50.0 g NaOH 8.00 g water 250.0 g HCl 8.00 g 33.5℃ (3) | 2015.05.25 |
| 0.600 M HNO3 + 0.300 M Ba(OH)2 18.46℃ (3) | 2015.05.20 |
| 325 J/℃ 0.900 M HCl 85.0 mL 0.900 M KOH 85.0 mL 18.24℃ (5) | 2015.05.20 |

댓글