발열반응 흡열반응
발열 과정에서 생성물의 결합이 반응물의 결합보다 더 강한 이유는 무엇인가요?
---------------------------------------------------
▶ 참고: 제5장 열화학. 목차
[ https://ywpop.tistory.com/15205 ]
---------------------------------------------------
발열 과정 그래프의 퍼텐셜 에너지 준위를 보면,
생성물의 에너지 준위가 반응물보다 더 낮습니다.
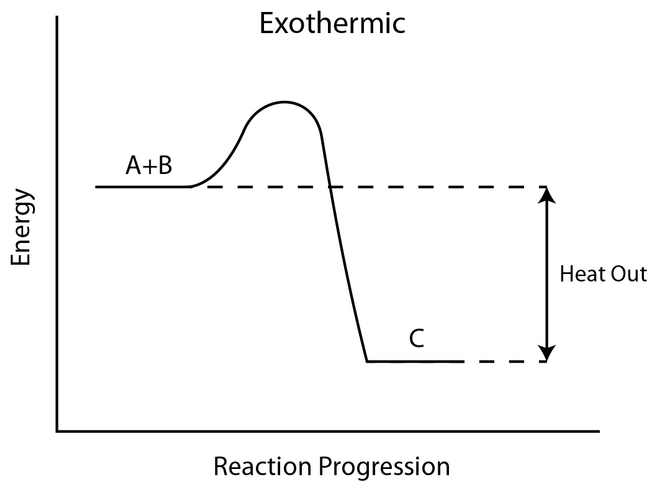
[ 그림 출처 commons.wikimedia.org ] 발열 과정. 발열 반응.
Energy level diagram of an exothermic reaction.
에너지가 준위가 더 낮으면 더 안정합니다.
더 안정한 화합물의 결합을 깨뜨리려면 더 많은 에너지가 필요합니다.
어떤 결합을 깨뜨리는데 더 많은 에너지가 필요할수록
그 결합은 더 강한 결합입니다.

[ 그림 출처 commons.wikimedia.org ] 흡열 과정. 흡열 반응.
Energy level diagram of an endothermic reaction.
---------------------------------------------------

▶ 발열(exothermic) 과정, 발열 반응. 계가 주위로 에너지를 방출한다.
▶ ΔE < 0: 계의 내부 에너지 감소
▶ 발열 이름에서 알 수 있듯이, 열의 형태로 감소 → ΔH < 0

▶ 흡열(endothermic) 과정, 흡열 반응. 계가 주위의 에너지를 흡수한다.
▶ ΔE > 0: 계의 내부 에너지 증가
▶ 흡열 이름에서 알 수 있듯이, 열의 형태로 증가 → ΔH > 0
[참고] ΔH와 Q의 관계. 숫자 값은 같고, 부호는 서로 반대.
▶ 발열 반응이면, 즉 ΔH < 0 이면, Q > 0
▶ 흡열 반응이면, 즉 ΔH > 0 이면, Q < 0
( 참고: 열화학 반응식 https://ywpop.tistory.com/6398 )

▶ 발열 반응, exothermic (ΔH < 0)
> 계의 엔탈피는 감소한다.
> 계를 은행 계좌라고 가정하면,
돈(= 반응열)이 인출되어, 잔금(= 엔탈피)이 감소한 경우.

▶ 흡열 반응, endothermic (ΔH > 0)
> 계의 엔탈피는 증가한다.
> 계를 은행 계좌라고 가정하면,
돈(= 반응열)이 입금되어, 잔금(= 엔탈피)이 증가한 경우.
[ 관련 글 https://ywpop.tistory.com/9152 ] 엔탈피의 정의, 엔탈피의 개념
[키워드] 발열 반응 흡열 반응 기준문서, 발열 흡열 기준문서, 반응열 기준문서, 반응 좌표 기준문서, 반응 경로 기준문서, 발열반응 기준문서, 흡열반응 기준문서, 발열 흡열 사전, 발열반응 사전, 흡열반응 사전
'일반화학 > [05장] 열화학' 카테고리의 다른 글
| 열용량과 비열. CaO의 반응열 (0) | 2016.06.07 |
|---|---|
| 물질의 퍼텐셜 에너지 (potential energy, Ep) (0) | 2016.06.06 |
| 화학적 일. 압력-부피 일. PV-Work (0) | 2016.05.18 |
| 커피컵 열량계. KBr의 용해열 측정 (0) | 2016.05.14 |
| 헤스의 법칙. NO(g) + O(g) → NO2(g) 반응의 ΔH 계산 (0) | 2016.05.03 |
| 일정 부피 열계량법(= 통 열계량법)에서, ΔH = ΔE (0) | 2016.05.02 |
| 벤조산 0.1584 g 열용량과 바닐린 0.2130 g 연소열 (0) | 2016.04.06 |
| 물의 비열 (Specific Heat, C) ★ (3) | 2016.03.25 |



댓글