85% 인산 시약으로 5% 인산 용액 만들기
가령, 5% 인산 용액을 500 g 만든다면,
용액 제조에 필요한 85% 인산 시약의 질량을
묽힘 법칙으로 계산하면,
MV = M’V’
( 참고 https://ywpop.tistory.com/2859 )
(85%) × (? g) = (5%) × (500 g)
? = 5 × 500 / 85 = 29.4118 g 시약
85% 인산 시약 29.4118 g과 물 470.5882 g을 혼합하면,
( 500 g – 29.4118 g = 470.5882 g )
5% 인산 용액 500 g이 됩니다. (정확한 농도)
> 농도가 질량 백분율인 용액을 질량 단위로 희석(제조)하면,
어떠한 문제도 발생하지 않습니다.
만약 5% 인산 용액을 500 mL 만든다면,
85% 인산 시약의 밀도 = 1.689 g/mL 이므로,
( 참고 https://ywpop.tistory.com/5667 )
29.4 g / (1.689 g/mL) = 17.4067 mL 시약
85% 인산 시약 17.4067 mL와 물 482.5933 mL를 혼합하면,
( 500 mL – 17.4067 mL = 482.5933 mL )
대략 5% 인산 용액 500 mL가 됩니다.
( 참고: 이상용액과 실제용액 https://ywpop.tistory.com/9525 )
[검산]
5% 인산 용액의 밀도 = 1.0255 g/mL 이므로,
5% 인산 용액 500 mL의 질량을 계산하면,
500 mL × (1.0255 g/mL) = 512.7500 g 용액
5% 인산 용액 512.7500 g에 들어있는 순수한 인산의 질량을 계산하면,
512.7500 g × (5/100) = 25.6375 g 인산
( 참고 https://ywpop.tistory.com/9293 )
25.6375 g 인산을 포함하는 85% 인산 시약의 질량을 계산하면,
25.6375 g / (85/100) = 30.1618 g 시약
85% 인산 시약의 밀도 = 1.689 g/mL 이므로,
30.1618 g 시약에 해당하는 부피는
30.1618 g / (1.689 g/mL) = 17.8578 mL 시약
따라서 85% 인산 시약 30.1618 g (또는 17.8578 mL)와
물 482.5882 g (= 482.5882 mL)를 혼합하면,
( 512.7500 g – 30.1618 g = 482.5882 g )
5% 인산 용액 512.7500 g (= 500 mL)가 됩니다.
( 17.8578 mL + 482.5882 mL = 500.446 mL )
> 단위환산에 사용된 밀도 값에 오차가 포함되어 있기 때문에,
약간의 오차가 발생합니다.
> 이 때문에 질량 단위인 퍼센트농도 용액의 양을 부피 단위로 만든다면,
약간의 오차는 감안해야 합니다.
---------------------------------------------------
[공식 유도]
> 만들고자 하는 묽은 용액의 퍼센트농도, c = 5%
> 만들고자 하는 묽은 용액의 부피, v = 500 mL
> 만들고자 하는 묽은 용액의 밀도, d = 1.0255 g/mL
> 묽은 용액의 질량 = 500 × 1.0255
> 묽은 용액에 들어있는 용질의 질량 = 500 × 1.0255 × (5/100)
> 사용하는 진한 용액의 퍼센트농도, C = 85%
> 필요한 진한 용액의 질량 = 500 × 1.0255 × (5/100) / (85/100)
> 사용하는 진한 용액의 밀도. D = 1.689 g/mL
> 필요한 진한 용액의 부피, V
= 500 × 1.0255 × (5/100) / (85/100) / 1.689 = 17.8578 mL
▶ 관계식: C × V × D = c × v × d
( 묽힘법칙과 유사 )
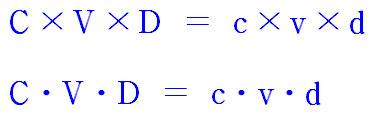
① V × D = (mL) × (g/mL) = g = 용액의 질량
② C = (용질의 질량 / 용액의 질량)
③ C × V × D = (용질의 질량 / 용액의 질량) × 용액의 질량 = 용질의 질량
④ C × V × D = c × v × d
희석전 용질의 질량 = 희석후 용질의 질량
---> 묽힘법칙과 100% 동일.
▶ 공식: V = (c × v × d) / (C × D)
= (5 × 500 × 1.0255) / (85 × 1.689) = 17.8578 mL
이렇게 계산한 85% 인산 시약 17.8578 mL와
물 482.1422 mL를 혼합하면,
( 500 mL – 17.8578 mL = 482.1422 mL )
5% 인산 용액 500 mL가 됩니다.
또는 85% 인산 시약 17.8578 mL에다
500 mL 되도록 물을 가해도 됩니다.
---> 실제로는 이렇게 용액을 만듭니다.
( 관련 글 https://ywpop.tistory.com/21599 )
[해설]
질량 퍼센트 농도의 시약으로 부피 단위의 용액을 제조할 경우에는,
질량을 부피로 환산하는 계산 과정에서 오차가 포함되고,
또한 환산에 사용된 밀도 역시 오차를 포함하고 있으므로,
( 용액의 부피가 온도에 따라 변하므로, 밀도 역시 변하기 때문에... )
어느 정도 오차는 감안해야 합니다.
만약 실험에 매우 정확한 농도의 용액이 필요하다면,
(만들기 까다롭더라도) 용액도 질량 단위로 제조해야 됩니다.
예) 고체 시약으로 20 wt% 용액 1 L 만들기
---------------------------------------------------
정확한 농도로 20 wt% 용액을 제조하려면,
그리고 그 양은 반드시 1 L이어야만 한다면,
20% = (? g / 1100 g) × 100
? = 1100 × (20/100) = 220 g
220 g 시약 + 880 g 증류수 = 1100 g 용액
---> 이렇게 혼합해서 만들면 용액은 1 L가 조금 넘을 것이고,
넘는 양은 버리고, 1 L를 취하면 됩니다.
즉, 농도는 질량 백분율인데,
만들고자 하는 용액의 양은 부피 단위이면,
그냥은 절대로 정확하게 만들 수 없습니다.
[키워드] 퍼센트농도를 부피로 기준문서, 퍼센트 농도를 부피로 기준문서, 퍼센트농도용액을 부피로 기준문서, 퍼센트농도 용액을 부피로 기준문서, 퍼센트 농도 용액을 부피로 기준문서, 질량퍼센트를 부피로 기준문서, 질량퍼센트 용액을 부피로 기준문서, 질량퍼센트 농도를 부피로 기준문서, 85% 인산 기준문서, cvd 기준문서, cvd dic
'화학 > 용액의 농도' 카테고리의 다른 글
| 50 ppm FeCl3 용액의 몰농도 (0) | 2016.10.15 |
|---|---|
| 0.025 N KMnO4 용액 1 L 제조에 필요한 KMnO4 질량(g) (0) | 2016.10.08 |
| 황산의 노르말농도. 리터 당 H2SO4 86 g 포함 (0) | 2016.09.30 |
| 95% 황산(d 1.84) 시약으로 0.1 N H2SO4 용액 1000 mL 만들기 (0) | 2016.09.05 |
| NaOH 60 g 용해된 용액 2 L의 몰농도 (0) | 2016.07.14 |
| 10% NaOH 용액의 몰농도 (0) | 2016.06.20 |
| 0.3 N BaCl2*2H2O (몰질량 244.26 g/mol) 용액 500 mL 만들기 (0) | 2016.06.18 |
| 노르말농도 계산 공식 설명(증명) (3) | 2016.06.16 |
댓글