728x170
35% 염산 용액의 묽힘(희석)
------------------------------------------
35% 염산 용액이 100 g 있다고 가정하면,
------------------------------------------
35% 염산 용액의 몰농도를 계산하면,
(1) 용질(염산)의 몰수 = (35 g) / (36.46 g/mol) = 0.96 mol
(염산의 몰질량 = 36.46 g/mol)
(2) 용액의 L수 = (100 g) / (1.18 g/mL) = 84.746 mL = 0.084746 L
(35% 염산 용액의 밀도 = 1.18 g/mL)
(3) 몰농도 = 용질의 몰수 / 용액의 L수 = 0.96 mol / 0.084746 L = 11.33 M
------------------------------------------
이제 용액의 묽힘(희석) 원리를 이용하여 원하는 몰농도의 용액을 조제합니다.
(4) 용액의 묽힘(희석) 원리
진한 용액의 용질의 몰수 = 묽은 용액의 용질의 몰수
가령, 0.3 M 수용액 500 mL를 조제한다면,
11.33 M × ? mL = 0.3 M × 500 mL
? = 13.24 mL
35% 염산 13.24 mL를 피펫으로 분취하여 500 mL 용량플라스크에 넣고, 용량플라스크의 표시선까지 증류수를 채우면 됩니다.
반응형
그리드형(광고전용)
'화학' 카테고리의 다른 글
| 원자가 전자(valence electrons) 수 결정하기 (6) | 2014.10.10 |
|---|---|
| I- + NO2- 산화-환원 반응식(redox reaction) 완성하기 (1) | 2014.10.08 |
| 용액의 질량백분율, 몰농도로부터 비중, 몰랄농도 계산 (0) | 2014.10.08 |
| 바닥상태 원자의 전자배치, Electron configurations of the elements (0) | 2014.10.08 |
| iodate anion, IO3-을 포함하는 산화-환원 반응식 균형 맞추기(Balancing redox equation) (0) | 2014.10.06 |
| 3% 과산화수소(H2O2) 용액의 몰농도 (0) | 2014.10.04 |
| 용액의 농도 환산: 질량 백분율, 몰농도, 몰랄농도, 몰분율 (0) | 2014.09.30 |
| [총괄성-어는점내림] 수용액의 어는점내림 (0) | 2014.09.30 |

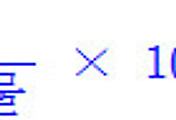



댓글