농도변경. %농도를 %농도로 변경. 퍼킨스 계산법
▶ A% 용액과 B% 용액을 혼합하여, C% 용액을 만들 때
( calculate alligation ratio )

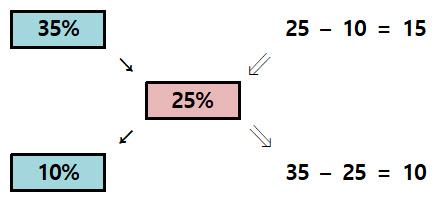
예제 1) 35% 용액과 10% 용액을 혼합하여, 25% 용액을 만들 때,
두 용액의 혼합 비율 = 35% : 10% = 15 : 10
또는
35% 용액의 양 = x, 10% 용액의 양 = y 라고 두면,
(35x + 10y) / (x + y) = 25 이므로, 정리하면,
35x + 10y = 25x + 25y
10x = 15y
x : y = 15 : 10 = 35% : 10%
예제 2) 35% 용액과 증류수를 혼합하여, 25% 용액을 만들 때,
( 증류수의 %농도 = 0% )
두 용액의 혼합 비율 = 35% : 0% = 25 : 10

[ 관련 글 https://ywpop.tistory.com/2859 ] 묽힘법칙. MV = M’V’
[ 관련 예제 https://ywpop.tistory.com/17136 ] 25.4% 용액을 23% 용액으로
[ 관련 예제 https://ywpop.tistory.com/18478 ] 48% 용액을 30% 용액으로
[키워드] 퍼킨스 기준문서, 묽힘 기준문서, 희석 기준문서, mv 기준문서, 농도환산 기준문서, 혼합비율 기준문서, 묽힘법칙 기준문서, 분석화학 기준문서, 퍼킨스 사전, alligation ratio dic
▶ Calculate alligation ratio of solutions of two different concentrations
to prepare intermediate concentration.
▶ Alligation is a simple technique
of mixing two solutions of different concentrations
to produce an intermediate concentration.
'화학 > 용액의 농도' 카테고리의 다른 글
| 용액의 몰농도와 부피, 용질의 몰질량(순도, 밀도)으로 용액 만들기 (2) | 2016.11.02 |
|---|---|
| Na2S2O3 용액의 몰농도 = 노르말농도 (0) | 2016.10.30 |
| 노르말농도의 정의 ★★ (18) | 2016.10.28 |
| 2차 표준용액(0.1 N HCl)을 이용한 0.1 N NaOH 용액의 역가 측정 ★ (1) | 2016.10.27 |
| 황산 49 g이 들어있는 500 mL 용액의 노르말농도 (0) | 2016.10.18 |
| 50 ppm FeCl3 용액의 몰농도 (0) | 2016.10.15 |
| 0.025 N KMnO4 용액 1 L 제조에 필요한 KMnO4 질량(g) (0) | 2016.10.08 |
| 황산의 노르말농도. 리터 당 H2SO4 86 g 포함 (0) | 2016.09.30 |
댓글