NaHCO3 용액의 pH
양쪽성양성자성(amphiprotic) 물질로 만든 용액의 pH
Determine the pH of a 0.1 M solution of NaHCO3 (sodium bicarbonate). The H^+ concentration for this solution is determined by the dissociations of carbonic acid (H2CO3), for which Ka1 = 4.2×10^-7 and Ka2 = 4.8×10^-11.
[참고] NaHCO3는 가용성 염이므로,
다음과 같이 물에서 100% 이온화된다고 가정한다.
NaHCO3(aq) → Na^+(aq) + HCO3^-(aq)
NaHCO3 is amphiprotic species just like NaHSO4, NaHS, Na2HPO4, NaH2PO4, etc.
In such cases the solution pH is dependent on the two ionization constants of the amphiprotic substance and independent of the concentration of the amphiprotic substance in the solution.
양쪽성양성자성 물질로 만든 용액의 pH는
양쪽성양성자성 물질의 두 개의 이온화 상수에만 의존하고,
용액 내 양쪽성양성자성 물질의 “농도와는 무관”하다.
( 예: 0.1 M NaHCO3 용액의 pH = 1.0 M NaHCO3 용액의 pH )
왜냐하면,
NaHCO3 용액 즉, HCO3^- 용액에서 [H^+]는
1) HCO3^-(aq) ⇌ H^+(aq) + CO3^2-(aq)
과정에 의해 증가 또는
2) HCO3^-(aq) + H+^(aq) ⇌ H2CO3(aq)
과정에 의해 감소하기 때문이다.
따라서
양쪽성양성자성 물질로 만든 용액의 pH는
다음과 같은 근사식으로 계산할 수 있다.
pH ≒ (pKa1 + pKa2) / 2
> Ka1, Ka2: dissociation constants of the conjugate acid of amphiprotic species
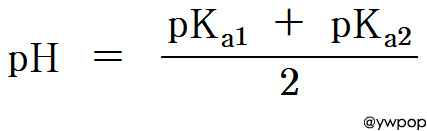
For NaHCO3,
pH = (pka1 + pka2) / 2
= (6.3768 + 10.3188) / 2 = 8.35
> pKa1 = –log(4.2×10^(-7)) = 6.3768
> pKa2 = –log(4.8×10^-(11)) = 10.3188
또는
pH = (pka1 + pka2) / 2
= (6.37 + 10.25) / 2 = 8.31
Ka1 = 4.3×10^(-7) ( pKa1 = 6.37 )
Ka2 = 5.6×10^(-11) ( pKa2 = 10.25 )
( 자료 출처 https://ywpop.tistory.com/4278 )
NaHCO3 용액의 pH > 7 이므로,
NaHCO3는 염기성염, 즉 염기(base)이다.
( 탄산수소나트륨은 염기성염, 즉 염기. )
( 참고: 탄산나트륨은 염기성염 https://ywpop.tistory.com/11140 )
[참고] NaHCO3 용액의 [OH^-]
> NaHCO3 용액의 pH = 8.35
> pOH = 14.00 – 8.35 = 5.65
> [OH^-] = 10^(-5.65) = 2.24×10^(-6) M
H3PO4의 경우,
H3PO4(aq) ⇌ H^+(aq) + H2PO4^-(aq) ... Ka1
pKa1 = –log(7.5×10^(-3)) = 2.1249
H2PO4^-(aq) ⇌ H^+(aq) + HPO4^2-(aq) ... Ka2
pKa2 = –log(6.2×10^(-8)) = 7.2076
HPO4^2-(aq) ⇌ H^+(aq) + PO4^3-(aq) ... Ka3
pKa3 = –log(4.8×10^(-13)) = 12.3188
이므로,
For NaH2PO4,
pH = (pka1 + pka2) / 2
= (2.1249 + 7.2076) / 2 = 4.67
---> NaH2PO4는 산성염, 즉 산(acid).
For Na2HPO4,
pH = (pKa2 + pKa3) / 2
= (7.2076 + 12.3188) / 2 = 9.76
---> Na2HPO4는 염기성염, 즉 염기(base).
[ 관련 글 https://ywpop.tistory.com/11141 ] 탄산나트륨과 탄산수소나트륨은 염기성염
[ 관련 글 https://ywpop.tistory.com/8464 ] NaHCO3 용액의 pH
[ 관련 글 https://ywpop.tistory.com/7764 ] NaHCO3 용액의 액성. 산성? 염기성?
[ 관련 글 https://ywpop.tistory.com/4752 ] 탄산수소나트륨 용액의 pH
[키워드] 양쪽성양성자성 물질의 pH 기준, 양쪽성양성자성 용액의 pH 기준, 다가산의 pH 기준, 다양성자산의 pH 기준, NaH2PO4 용액의 pH 기준, Na2HPO4 용액의 pH 기준, NaHCO3 양쪽성 기준, NaHCO3 양쪽성양성자성 물질 기준, NaHCO3의 이온화 기준, NaHCO3 → Na^+ + HCO3^-, 탄산수소나트륨 용액의 pH 기준, NaHCO3 용액의 pH 기준, NaH2PO4 acid or base, Na2HPO4 acid or base, 양쪽성양성자성 물질의 pH 사전, 양쪽성양성자성 용액의 pH 사전, 다가산의 pH 사전, 다양성자산의 pH 사전, pH = (pKa1 + pKa2) / 2 기준, pH = (1/2) (pKa1 + pKa2) 기준, pH = pKa1 + pKa2 기준, pH = pKa1 + pKa2 dic
'일반화학 > [16장] 산-염기 평형' 카테고리의 다른 글
| 약염기-강산 적정(당량점 이전). 0.1 M NH3 + 0.02 M HCl (0) | 2018.04.17 |
|---|---|
| KOH 0.108 M HCl 45.3 mL KOH gram (0) | 2018.03.28 |
| aMV = bM’V’ 적정. 0.128 M HCl + 2.87 g Mg(OH)2 (0) | 2018.03.28 |
| MV = M’V’ 적정. 0.0875 M NaOH + 0.115 M HClO4 (0) | 2018.03.28 |
| 0.1 M NH3 용액의 pH (0) | 2017.12.18 |
| 0.3 M 메틸아민(CH3NH2)의 평형 농도. pH 12 (0) | 2017.12.15 |
| 0.20 M H2C2O4 용액의 pH와 [C2O4^2-] (0) | 2017.12.15 |
| 약산의 짝염기 쓰기 (0) | 2017.12.02 |

댓글