전기화학에서 매우 중요한 관계식. 반드시 암기
[참고] 제20장 전기화학. 목차
[ https://ywpop.tistory.com/11389 ]

(1) ΔG°와 E° 사이의 관계식 (자유에너지와 기전력의 관계)
자유에너지와 기전력 관계 ( 기전력과 자유에너지 관계 )
ΔG° = –nFE°
( ΔG = –nFEcell )
( E > 0 일 때, ΔG < 0 이므로, 자발적 반응. )
[ 상세 설명 https://ywpop.tistory.com/10066 ]
[ 관련 예제 ]
[참고] –nFE의 단위
n의 단위는 없으므로,
–nFE = –(C/mol) (V)
= –C•V/mol
1 J = 1 C•V 이므로,
= –J/mol
[참고] 1 패러데이(Faraday), F의 정의
① 전기분해하여 물질 1그램당량을 얻는데 필요한 전하량(전기량)
( 또는 전기분해하여 물질 1당량(eq)을 얻는데 필요한 전하량 )
② 전자 1 mol의 전하량
③ 1 F = 96485 C/mol e^-
= 96485 J/V•mol e^-
= 전자의 전하량(1.6022×10^(-19) C/e^-) × 아보가드로수(6.022×10^23 /mol)
( 예제 https://ywpop.tistory.com/20339 )
(2) ΔG°와 K 사이의 관계식 (자유에너지와 평형상수의 관계)
자유에너지와 평형상수 관계 ( 평형상수와 자유에너지 관계 )
ΔG° = –RTlnK
( ΔG = –RTlnK )
[ 상세 설명 https://ywpop.tistory.com/10336 ]
(3) E°와 K 사이의 관계식 (기전력과 평형상수의 관계)
기전력과 평형상수 관계 ( 평형상수와 기전력 관계 )
E° = RT/nF lnK
( E = RT/nF lnK )
E° = 0.0592/n logK
from 네른스트 식,
E = E° – (0.0592 / n) log(Q)
( 참고 https://ywpop.tistory.com/2900 )
Q = K 일 때, E = 0 이므로,
E° = (0.0592 / n) log(K)

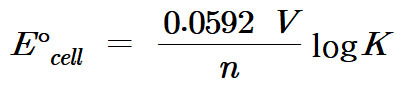
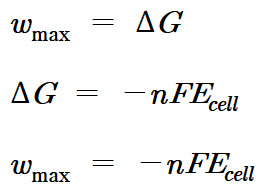
w_max = ΔG
ΔG = –nFE_cell
w_max = –nFE_cell (단위: J/mol)
[ 관련 예제 https://ywpop.tistory.com/16647 ] 298 K에서 Cu(s) + 2Ag^+(aq) → Cu^2+(aq) + 2Ag(s) 반응의 평형상수 계산
[키워드] 전기 화학에서 중요한 기준문서, 전기 화학에서 매우 중요한 기준문서, 전기 화학 관계식 기준문서, 기전력과 자유 에너지 기준문서, 자유 에너지와 기전력 기준문서, 평형 상수와 자유 에너지 기준문서, 자유 에너지와 평형 상수 기준문서, 평형 상수와 기전력 기준문서, 기전력과 평형 상수 기준문서, 전기 화학 공식 기준문서, 전기 화학 암기 기준문서, 전기 화학 관계식 사전, 기전력과 자유 에너지 사전, 자유 에너지와 기전력 사전, 평형 상수와 자유 에너지 사전, 자유 에너지와 평형 상수 사전, 평형 상수와 기전력 사전, 기전력과 평형 상수 사전, 전기 화학 공식 사전, 전기 화학 암기 사전, 전기 화학 사전, ΔG = –nFE dic, ΔG = –RT lnK dic
'일반화학 > [20장] 전기화학' 카테고리의 다른 글
| 전기분해의 화학량론. CuSO4 수용액 3.2 A 45분 (0) | 2017.04.28 |
|---|---|
| redox balance. MnO4^- + NO2^- → Mn^2+ + NO3^- (acidic) (0) | 2017.04.24 |
| redox balance. Cu + NO3^- → Cu^2+ + NO (acidic) (basic) (0) | 2017.04.14 |
| redox balance. Sn^2+ + MnO4^- → Mn^2+ + Sn^4+ (acidic) (0) | 2017.02.13 |
| redox balance. MnO4^- + C2O4^2- → Mn^2+ + CO2 (acidic.basic) (2) | 2016.12.03 |
| 산화-환원 반응 균형 맞추기. 염기성 용액에서 (0) | 2016.11.27 |
| redox balance. Bi(OH)3 + SnO2^2- → SnO3^2- + Bi (basic) (0) | 2016.11.27 |
| redox balance. Cu + NO3^- → Cu^2+ + NO2 (acidic) (0) | 2016.11.27 |


댓글