오존(Ozone, O3)의 루이스 구조
Lewis Structure of O3 (Ozone)
---------------------------------------------------
▶ 참고: 루이스 구조 그리는 방법 [ https://ywpop.tistory.com/6302 ]
▶ 참고: PCl3 루이스 구조 그리기 [ https://ywpop.tistory.com/2541 ]
---------------------------------------------------
1. 각 원자의 원자가전자 수를 더한다.
O3 = 3(6) = 18
2. 원자들을 배치시키고, 단일결합으로 연결하고, (첫 번째 그림)
단일결합 수만큼 전자 수를 뺀다.
18 – 2(2) = 14
3. 주위원자부터 옥텟규칙에 맞도록 한 쌍씩 전자를 그린 다음, (두 번째 그림)
그린 전자 수만큼 뺀다.
14 – 2(6) = 2
4. 중심원자도 옥텟규칙에 맞도록 한 쌍씩 전자를 그린다. (세 번째 그림)
남아있는 전자가 부족하면, 주위원자의 비결합 전자를 당겨,
다중결합을 만든다. (네 번째, 다섯 번째 그림)
5. 오존은 2개의 공명 구조를 가진다. (네 번째, 다섯 번째 그림)
RED ↔ BLUE

[참고] 오존의 형식전하
파랑색 구조에서 왼쪽부터 순서대로 각 산소의 형식전하를 계산하면,
형식전하 = 원자가전자수 – 비결합전자수 – (결합전자수/2)
( 참고 https://ywpop.tistory.com/2544 )
1) 6 – 4 – (4/2) = 0
2) 6 – 2 – (6/2) = +1
3) 6 – 6 – (2/2) = –1

[ 그림 출처 wikimedia ] 오존의 공명 구조.
> 중심원자 산소의 형식전하 = +1
> 단일 결합 주위원자 산소의 형식전하 = –1

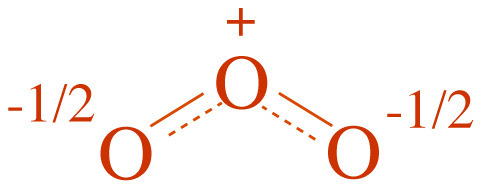
[그림] 오존의 공명 혼성(resonance hybrid) 구조.
( 오존의 실제 구조 )
---> O–O 결합 길이는 서로 같다. (1.278 Å)
---> 양끝 산소 원자의 전하는 –1/2.
---> 오존에서 O–O 결합을 ‘1.5’ 결합으로 설명하기도 한다.
( 참고: 공명 구조 https://ywpop.tistory.com/2635 )
[참고] 산소-산소 원자간 결합 길이
> O–O 단일 결합: 1.48 Å
> O=O 이중 결합: 1.21 Å
[ 그림 출처 wikimedia ]
Q. O3 polar or nonpolar?
A. Ozone, O3 is polar.
각각의 O 원자에 형식 전하가 할당된다.
---> 중심 O와 주위 O에 존재하는 전자의 개수가 다르다.
---> O–O 결합은 극성 결합이며,
---> O3 분자는 극성 분자이다.
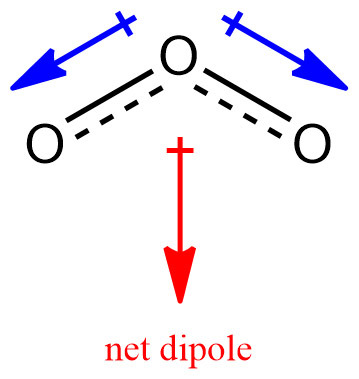
[그림] Net dipole moment of ozone, O3.
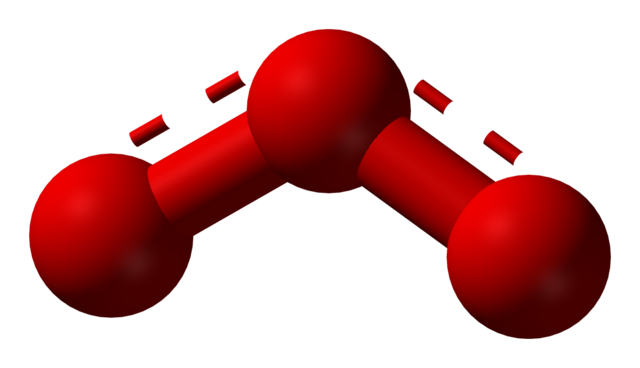
[그림] Ozone is a bent molecule.
오존 분자의 기하구조는 굽은형.
▶ 중심원자의 전자영역 = 3개
---> 중심원자의 혼성오비탈 = sp2 혼성
---> 전자영역의 기하구조 = Trigonal planar
( 참고 https://ywpop.tistory.com/11542 )
▶ 5개 전자영역 중,
> 주위원자(X) = 2
> 비공유전자쌍(Y) = 1
---> AX2E1
---> 분자의 기하구조 = V-shaped bent
[키워드] 오존 루이스 구조 기준문서, 오존 루이스 기준문서, 오존 기준문서, 오존 루이스 구조 사전, 오존 루이스 사전, 오존 사전, ozone polar or nonpolar
'일반화학 > [09장] 분자의 기하구조와 결합 이론' 카테고리의 다른 글
| 헬륨의 분자오비탈(궤도함수)과 결합차수 (0) | 2016.06.06 |
|---|---|
| 분자 오비탈 전자 배치, 산소 분자(O2), 이온 ★ (2) | 2016.05.30 |
| H2^+의 분자 오비탈(MO)과 결합 차수 (1) | 2016.05.27 |
| MO Diagrams of B2, C2, N2 (0) | 2016.05.25 |
| 아질산, HNO2의 루이스 구조 그리기 (0) | 2016.05.16 |
| N2와 N2+의 질소-질소 결합길이 (2) | 2016.04.05 |
| 왜 정사면체는 쌍극자모멘트가 0인가요? (0) | 2015.09.02 |
| SOCl2 루이스 구조 그리기 (0) | 2015.07.13 |




댓글