루이스 구조(Lewis structure) 그리기. PCl3
PCl3 루이스 구조 그리기. Lewis structure of PCl3
---------------------------------------------------
▶ 참고: 제8장 화학 결합의 기본 개념. 목차
[ https://ywpop.tistory.com/15249 ]
▶ 참고: 루이스 구조 그리기
[ https://ywpop.tistory.com/6302 ]
---------------------------------------------------
[1] Lewis 구조. Lewis structure
▶ ‘분자’를 나타내는(표현하는) 방식의 하나. 구조식의 일종.
( 참고: 화학식 https://ywpop.tistory.com/2391 )
▶ 결합 전자 & 비결합 전자(비공유전자쌍), 둘 다 모두 나타낸다.
▶ 결합 전자는 선으로, 비결합 전자는 점으로 나타낸다.
---> 이렇게 나타내는 것이 그리기도 좋고, 이해하기도 좋다.
▶ 루이스 구조를 그릴 때,
주위 원자의 비공유 전자쌍은 생략할 수도 있다.
단, 어떠한 경우에도
중심 원자의 비공유 전자쌍은 생략하면 안된다.
---> 중심 원자의 비공유 전자쌍은 반드시 나타내야 한다.
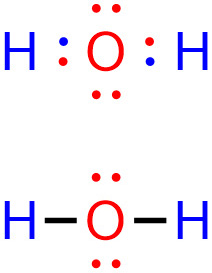
[그림] H2O의 루이스 구조.
점-선 구조가 분자내 원자간 결합 상태를 보다 쉽게 알아볼 수 있다.
> 결합전자 = 결합전자쌍 = 공유전자쌍
> 비결합전자 = 비결합전자쌍 = 비공유전자쌍 = 고립전자쌍
> Lewis structures (루이스 구조)
= Lewis dot diagrams
= Lewis dot formulas
= Lewis dot structures (루이스 점 구조)
= electron dot structures (전자 점 구조)
= Lewis electron dot structures (루이스 전자 점 구조)
[2] Lewis 구조 그리기
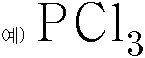
[1단계] 각 원자의 원자가 전자 수의 합을 구한다.
(P) + 3(Cl) = (5) + 3(7) = 26
이 값에, 만약,
① 양이온이면, 전하 수만큼 빼고,
② 음이온이면, 전하 수만큼 더한다.
[2단계] 분자의 기본 골격 구조를 그린다.
① 중심 원자와 주위 원자 결정.
원자가 전자 수가 4에 가까운 원자를 중심에 둔다.
만약 원자가 전자 수가 같거나, 또는 3개와 5개처럼,
원자가 전자 수로 결정할 수 없으면,
전기음성도가 더 작은 원자를 중심에 둔다.
( 참고: 전기음성도 https://ywpop.tistory.com/2567 )
② 중심 원자의 상/하/좌/우(또는 일직선) 자리에
주위 원자들을 배치한다.
중심 원자와 주위 원자들을 단일 결합으로 연결한다.
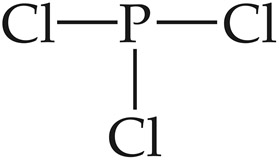
③ 1단계에서 구한 원자가 전자 수의 합에서,
단일 결합 1개 당 전자 2개씩 뺀다.
26 – 3(2) = 20
[3단계] 주위 원자들이 팔전자 규칙에 맞도록 전자를 한 쌍씩 그린다.
( 무조건, 그냥 주위 원자 주변에 전자쌍 3개씩 그린다. )
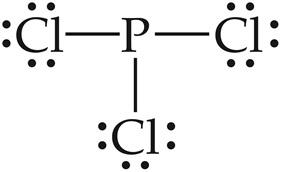
2단계에서 남은 원자가 전자 수의 합에서,
그린 전자쌍만큼 전자 수를 뺀다.
20 – 3(6) = 2
[4단계] 중심 원자도 팔전자 규칙에 맞도록 그린다.
중심 원자도 팔전자 규칙에 맞나? Yes → Stop.
중심 원자도 팔전자 규칙에 맞나? No → 3단계에서 남은 원자가 전자가 있나?
① Yes → 2개 있다.
중심 원자에 전자 한 쌍씩 그린다, 모두 사용할 때까지.
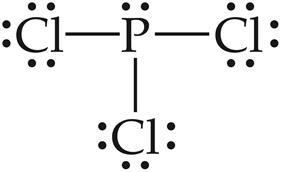
[완성] PCl3의 루이스 구조.
② No → 주위 원자의 비결합 전자쌍을 사용하여
이중 또는 삼중 결합을 그린다,
중심 원자도 팔전자 규칙에 맞을 때까지.
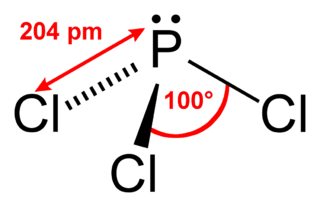
[그림] PCl3의 기하 구조. Trigonal Pyramid = 삼각피라미드 = 삼각뿔.
전자 영역 = 4 이고, 4개중 1개는 비공유 전자쌍이므로,
기본적인 기하 구조는 NH3와 같다.
> P의 혼성 오비탈 = sp^3 혼성 오비탈.
( 참고: VSEPR https://ywpop.tistory.com/2571 )
( 참고: 중심 원자의 혼성 오비탈 https://ywpop.tistory.com/11542 )
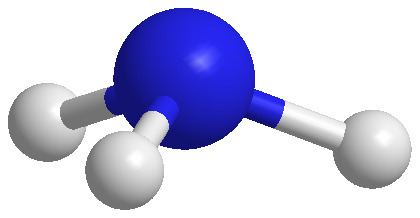
[그림] PCl3의 3-D 구조.
▶ 극성 결합을 가진 비대칭 분자이므로,
PCl3는 극성 분자이다.
> Phosphorus trichloride, PCl3 is polar.
> dipole moment: 0.97 D
▶ P → Cl은 극성 결합이고,
PCl3는 비대칭 분자이므로,
PCl3는 극성 분자.
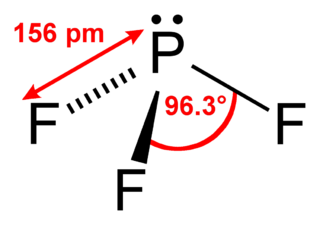
[그림] PF3의 루이스 구조. PF3의 기하 구조.
[키워드] PCl3의 루이스 구조, PCl3 루이스, 루이스 기준문서, 루이스 구조 기준문서, 루이스 구조식 기준문서, PF3 hybridization of central atom, PCl3 hybridization of central atom, PCl3 루이스 구조 사전, PCl3 루이스 구조식 사전
'일반화학 > [08장] 화학결합의 기본 개념' 카테고리의 다른 글
| 공유 결합의 종류, 분류 (0) | 2014.05.25 |
|---|---|
| 공유 결합. 결합 전자와 비결합 전자 ★ (0) | 2014.05.23 |
| 결합 엔탈피와 반응 엔탈피 ★ (1) | 2014.05.22 |
| 결합 엔탈피 (bond enthalpy) ★ (0) | 2014.05.21 |
| CO3^2- 루이스 구조 그리기. 탄산 이온 (3) | 2014.05.16 |
| 공유 결합성 화합물에서, 형식 전하와 산화수 ★ (0) | 2014.05.16 |
| 루이스 점 기호 (Lewis dot symbols, Lewis dot diagrams) (2) | 2014.05.12 |
| 옥텟 규칙의 예외 (P, S, Cl) (0) | 2012.06.22 |




댓글