아질산, HNO2의 루이스 구조 그리기
Lewis Structure of HNO2 (Nitrous acid)
---------------------------------------------------
▶ 참고: 루이스 구조 그리기
[ https://ywpop.tistory.com/6302 ]
---------------------------------------------------
[1단계] 각 원자의 원자가전자 수의 합을 구한다.
H + N + 2(O) = 1 + 5 + 2(6) = 18
[2단계] 분자의 기본 골격 구조를 그린다.
① 중심 원자와 주위 원자 결정.
원자가전자 수가 4에 가까운 원자 = 중심 원자 = 질소(N)
② 중심 원자의 상/하/좌/우(또는 일직선) 자리에 주위 원자들을 배치한다.
중심 원자와 주위 원자들을 단일 결합으로 연결한다.
H – O – N – O
③ 1단계에서 구한 원자가전자 수의 합에서, 단일 결합 1개 당 전자 2개씩 뺀다.
18 – 6 = 12
[3단계] 주위 원자들이 팔전자 규칙에 맞도록 전자를 한 쌍씩 그린다.
H – O(4) – N – O(6)
( 괄호 안 숫자는 비결합전자의 개수 )
2단계에서 남은 원자가전자 수의 합에서, 그린 전자쌍만큼 전자 수를 뺀다.
12 – 10 = 2
[4단계] 남은 전자를 사용하여 중심 원자도 팔전자 규칙에 맞도록 그린다.
H – O(4) – N(2) – O(6)
중심 원자도 팔전자 규칙에 맞나? No
→ 주위 원자의 비결합전자쌍을 사용하여 이중 또는 삼중 결합을 그린다,
중심 원자도 팔전자 규칙에 맞을 때까지.
H – O(4) – N(2) = O(4) 또는
H – O(2) = N(2) – O(6)
---> 옥텟 규칙을 만족하는 2가지 루이스 구조

[참고] [4c] 구조는 “red O의 결합 수 = 3” 이므로,
불안정한 구조일거라 추측할 수 있다.
형식 전하를 계산해서, 보다 안정한 루이스 구조를 결정하면,
형식전하 = 원자가전자 – 비결합전자 – (결합전자/2)
( 참고 https://ywpop.tistory.com/2568 )
H – O(4) – N(2) = O(4)
> red O(4)의 형식전하 = 6 – 4 – (4/2) = 0
> blue O(4)의 형식전하 = 6 – 4 – (4/2) = 0
H – O(2) = N(2) – O(6)
> red O(2)의 형식전하 = 6 – 2 – (6/2) = +1
> blue O(6)의 형식전하 = 6 – 6 – (2/2) = –1
따라서 아질산의 안정한 루이스 구조는
H – O(4) – N(2) = O(4)
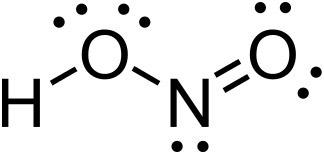
[그림] Lewis Structure of HNO2 (Nitrous acid).
[키워드] 아질산의 루이스 구조, HNO2 루이스 구조
'일반화학 > [09장] 분자의 기하구조와 결합 이론' 카테고리의 다른 글
| 분자 오비탈 전자 배치, 산소 분자(O2), 이온 ★ (2) | 2016.05.30 |
|---|---|
| H2^+의 분자 오비탈(MO)과 결합 차수 (1) | 2016.05.27 |
| MO Diagrams of B2, C2, N2 (0) | 2016.05.25 |
| 오존(Ozone, O3)의 루이스 구조 ★ (3) | 2016.05.22 |
| N2와 N2+의 질소-질소 결합길이 (2) | 2016.04.05 |
| 왜 정사면체는 쌍극자모멘트가 0인가요? (0) | 2015.09.02 |
| SOCl2 루이스 구조 그리기 (0) | 2015.07.13 |
| CS2 루이스 구조 그리기 (0) | 2015.07.11 |




댓글