분자 오비탈 전자 배치, 산소 분자(O2), 이온
Molecular orbital(MO) diagram of dioxygen ion
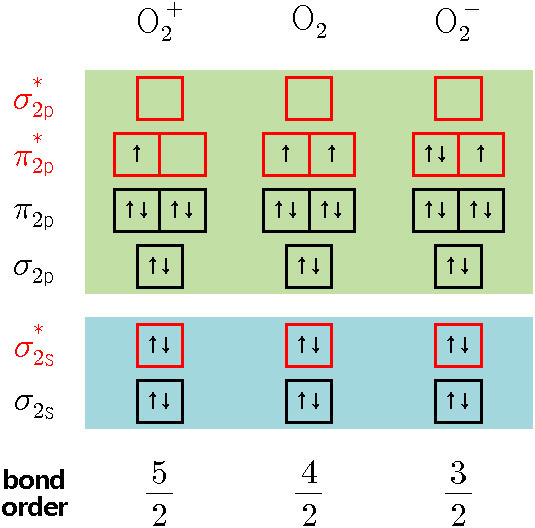
결합 차수 = 1/2 (결합성 MO 전자 수 – 반결합성 MO 전자 수)
( 참고 https://ywpop.tistory.com/6879 )
> O2^+의 결합 차수 = (6 – 1) / 2 = 5/2 = 2.5
> O2의 결합 차수 = (6 – 2) / 2 = 4/2 = 2
> O2^-의 결합 차수 = (6 – 3) / 2 = 3/2 = 1.5
( σ_2s 오비탈과 σ*_2s 오비탈에 채워진 전자의 수는 서로 같으므로,
2s 오비탈에 존재하는 전자들은 생략하고 계산해도 된다. )
※ O2^2-의 MO
> O2^-의 π*_2p 오비탈에 전자 1개를 추가하면,
---> O2^2-의 MO
> O2^2-의 결합 차수 = (6 – 4) / 2 = 1
※ O2, O2^+, O2^-, O2^2-의 상대적 안정도
> 결합 차수 순으로 나열하면,
---> O2^+ > O2 > O2^- > O2^2-

▶ 반결합성 MO에 전자가 더 많이 존재할수록,
결합 차수는 감소하고, 따라서 결합은 더 불안정해진다.
즉, 결합 에너지는 감소한다.
▶ 결합 차수와 결합 에너지는 비례 ⇨ O2^+ 가 가장 안정
(결합 에너지가 클수록 안정)
▶ 결합 차수와 결합 길이는 반비례 ⇨ O2^+ 가 가장 안정
(결합 길이가 작을수록 안정)
The bond order decreases and the bond length increases in the order
O2^+ (112.2 pm), O2 (121 pm), O2^- (128 pm) and O2^2- (149 pm).
[참고] σ_1s 오비탈과 σ*_1s 오비탈은 생략했습니다.
전자 배치는 σ_2s 오비탈과 σ*_2s 오비탈과 동일합니다.
각각의 오비탈에 채워진 전자의 수는 서로 같으므로,
결합 차수 계산에는 영향을 주지 않습니다.
[ 관련 글 https://ywpop.tistory.com/2901 ] O2, O2^2-의 MO
▶ O2^2-의 MO: π*_2p MO에 4개의 전자가 존재
> 결합 차수 = (6 – 4) / 2 = 1
> 홀전자의 개수 = 0개 (반자기성)
▶ O2^-의 MO: π*_2p MO에 3개의 전자가 존재
> 결합 차수 = (6 – 3) / 2 = 3/2
> 홀전자의 개수 = 1개 (상자기성)
▶ O2의 MO: π*_2p MO에 2개의 전자가 존재
> 결합 차수 = (6 – 2) / 2 = 2
> 홀전자의 개수 = 2개 (상자기성)
▶ O2^+의 MO: π*_2p MO에 1개의 전자가 존재
> 결합 차수 = (6 – 1) / 2 = 5/2
> 홀전자의 개수 = 1개 (상자기성)
▶ O2^2+의 MO: π*_2p MO에 0개의 전자가 존재
> 결합 차수 = (6 – 0) / 2 = 3
> 홀전자의 개수 = 0개 (반자기성)
[ 관련 글 https://ywpop.tistory.com/3224 ] 분자의 자기적 성질
[키워드] 결합성 분자오비탈 기준문서, 반결합성 분자오비탈 기준문서, 결합차수 기준문서, MO of O2 기준문서, O2의 MO 기준문서, 산소 분자의 MO 기준문서, 산소 분자의 분자 오비탈 기준문서, 산소 분자의 자기적 성질 기준문서, 산소의 자기적 성질 기준문서, MO of O2 dic, O2의 결합차수 사전
'일반화학 > [09장] 분자의 기하구조와 결합 이론' 카테고리의 다른 글
| CF4 루이스 구조 그리기. Lewis structure of CF4 (0) | 2016.11.24 |
|---|---|
| 분자 오비탈 (MO) 이론. MOT ★ (0) | 2016.10.19 |
| H2O는 평면 구조인가 입체 구조인가 ★ (0) | 2016.10.09 |
| 헬륨의 분자오비탈(궤도함수)과 결합차수 (0) | 2016.06.06 |
| H2^+의 분자 오비탈(MO)과 결합 차수 (1) | 2016.05.27 |
| MO Diagrams of B2, C2, N2 (0) | 2016.05.25 |
| 오존(Ozone, O3)의 루이스 구조 ★ (3) | 2016.05.22 |
| 아질산, HNO2의 루이스 구조 그리기 (0) | 2016.05.16 |




댓글