약산-약염기 염 용액의 pH. 0.250 M NH4F 용액의 pH
acidic, basic, or neutral salt?
Predict the pH of 0.250 M NH4F solution.
> Ka for HF = 7.1×10^(-4)
> Kb for NH3 = 1.8×10^(-5)
---------------------------------------------------
▶ 참고: 약산-약염기 염 용액의 pH
[ https://ywpop.tistory.com/4233 ]
---------------------------------------------------
[참고] 용액의 pH를 계산하기 전에...
Ka > Kb 이므로,
NH4F 용액은 산성임을 알 수 있다.
( NH4F는 산성염. )
따라서 pH는 7 미만 값으로 나와야 될 것이다.
NH4F는 가용성 염이기 때문에,
물에서 100% 이온화된다고 가정하면,
NH4F(s) + H2O(l) → NH4^+(aq) + F^-(aq)
NH4F : NH4^+ : F^- = 1 : 1 : 1 계수비 이므로,
[NH4F] = [NH4^+] = [F^-] = 0.250 M
NH4^+는 약염기(NH3)의 짝산(비교적 강한 산)이므로,
물과 가수분해 반응이 일어난다.
NH4^+(aq) + H2O(l) ⇌ NH3(aq) + H3O^+(aq)
( 참고: 가수분해 https://ywpop.tistory.com/5502 )
Kh = Ka = Kw / Kb
= (10^(-14)) / (1.8×10^(-5)) = 5.6×10^(-10)
평형상수 식에 평형에서의 농도를 대입하면,
Kh = x^2 / (0.250–x) = 5.6×10^(-10)
( 참고 https://ywpop.tistory.com/4294 )
0.250–x ≒ 0.250 이라 근사처리하면,
x = [(5.6×10^(-10)) (0.250)]^(1/2)
= 1.2×10^(-5) M = [H3O^+] = [H^+]
F^-는 약산(HF)의 짝염기(비교적 강한 염기)이므로,
물과 가수분해 반응이 일어난다.
F^-(aq) + H2O(l) ⇌ HF(aq) + OH^-(aq)
Kh = Kb = Kw / Ka
= (10^(-14)) / (7.1×10^(-4)) = 1.4×10^(-11)
평형상수 식에 평형에서의 농도를 대입하면,
Kh = x^2 / (0.250–x) = 1.4×10^(-11)
0.250–x ≒ 0.250 이라 근사처리하면,
x = [(1.4×10^(-11)) (0.250)]^(1/2)
= 1.9×10^(-6) M = [OH^-]
[H^+] = 1.2×10^(-5) M > [OH^-] = 1.9×10^(-6) M 이므로,
( H^+의 농도 > OH^-의 농도 )
H^+(aq) + OH^-(aq) → H2O(l) 반응 후
남아있는 [H^+]를 구하면
[H^+] = (1.2×10^(-5)) – (1.9×10^(-6))
= 1.0×10^(-5) M
pH = –log[H^+]
= –log(1.0×10^(-5)) = 5.0
답: pH = 5.0
---------------------------------------------------
또는
아래 공식으로 간단히 계산할 수도 있다.
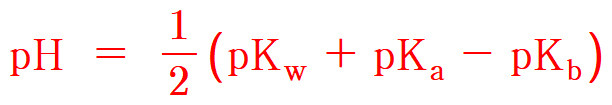
> pKa = –log(7.1×10^(-4)) = 3.149
> pKb = –log(1.8×10^(-5)) = 4.745
pH = 1/2 (pKw + pKa – pKb)
= 1/2 (14 + 3.149 – 4.745)
= 6.2
[참고] 약산-약염기 적정을 하지 않는 이유
> 약산-약염기 적정에서는 중화점(당량점)에서 일어나는
염의 가수분해 반응이 2개이기 때문이다.
---> 계산하기 귀찮아서 이런 적정은 안 한다.
> 더 중요한 이유는
약산-약염기 적정을 안해도 되기 때문이다.
( 참고 https://ywpop.tistory.com/2732 )
[ 관련 예제 https://ywpop.tistory.com/4298 ] NH4CN 용액의 pH
[ 관련 글 https://ywpop.tistory.com/4300 ] 산성염, 염기성염, 중성염
[키워드] NH4F 기준문서, 약산-약염기 염 용액의 pH 기준문서, 약산-약염기 염 기준문서, 약산-약염기 중화반응 기준문서, 약산-약염기 적정 기준문서, 약산-약염기 기준문서, 약산-약염기 염 용액의 pH 사전, 약산-약염기 염 사전, 약산-약염기 중화반응 사전, 약산-약염기 적정 사전, 약산-약염기 사전, NH4F dic
'일반화학 > [16장] 산-염기 평형' 카테고리의 다른 글
| 약산의 초기농도, Ka, pH 관계식 ★ (3) | 2015.11.19 |
|---|---|
| H2CO3 이온화 반응식의 ICE 도표와 Ka (0) | 2015.11.18 |
| 다양성자성 산의 이온화. Sulfurous acid, H2SO3 (1) | 2015.11.14 |
| 약산-약염기의 염 용액의 pH. 0.250 M NH4F 용액의 pH ★ (1) | 2015.11.11 |
| 10^–7 M HCl, 10^–8 M HCl과 같은 묽은 염산의 pH ★ (7) | 2015.11.09 |
| 탄산나트륨(sodium carbonate, Na2CO3)의 노르말농도(normality) (0) | 2015.10.22 |
| 약산의 산 이온화상수(산 해리상수), Ka와 pKa (0) | 2015.10.21 |
| 탄산칼슘은 염기성 염. CaCO3 basic salt ★ (2) | 2015.10.19 |


댓글