산-염기 중화 적정 과정에서 용액의 pH 계산: 강산-강염기 적정
중화 적정은 산-염기의 세기에 따라 다음과 같이 3가지 경우로 나눌 수 있다.
(1) 강산-강염기 적정
(2) 약산-강염기 적정 [ 참고 https://ywpop.tistory.com/2736 ]
(3) 강산-약염기 적정 [ 참고 https://ywpop.tistory.com/2742 ]
▶ 약산-약염기 적정에서는
염의 가수분해 반응이 2개이기 때문에, 계산이 복잡하다.
따라서 이런 중화 적정은 안 한다. 할 필요도 없고, 할 이유도 없다.
만약 시료가 약산이면 (2)번 적정으로, 약염기이면 (3)번 적정으로
시료의 농도를 구할 수 있기 때문이다.
▶ 일반적으로 표준 용액은 강산 또는 강염기를 사용한다.
본 글에서는 먼저 강산-강염기 적정 과정에서 용액의 pH를 구해보겠다.
시료인 강산을 표준 용액인 강염기로 적정한다고 가정한다.
[가정] 0.1 M HCl 25 mL (시료) ← 0.1 M NaOH (표준 용액)
원래 시료의 농도는 적정 실험을 통해 구해야하는 것이지만,
계산 과정을 보여주기 위해 이미 알고 있는 0.1 M 용액을 사용하겠다.
적정 중에는 다음과 같은 중화 반응이 일어난다.

산(= H^+) 1 mol은 화학량론적으로 정확히 염기(= OH^-) 1 mol과 반응한다.
☆ 첨가한 NaOH 부피 vs. 용액의 pH
1) 적정 전, NaOH 0 mL
적정 전, 즉 표준 용액을 가하기 전의
HCl의 몰농도와 용액의 pH는 다음과 같다.
HCl(aq) → H^+(aq) + Cl^-(aq)
[HCl] = [H^+] = 0.1 M
pH = –log[H^+] = –log(0.1) = 1
( 참고: pH의 정의 https://ywpop.tistory.com/2706 )
이때, HCl의 mol수는
(0.1 mol/L) × 0.025 L = 0.0025 mol
2) NaOH 10 mL 加 (중화점 전)
첨가한 NaOH의 mol수를 계산하면,
(0.1 mol/L) × 0.010 L = 0.001 mol
---> 이만큼 산이 중화된다.
( HCl + NaOH → NaCl + H2O )
따라서 남아있는 HCl의 mol수는
0.0025 – 0.001 = 0.0015 mol
이때 HCl의 몰농도와 용액의 pH는 다음과 같다.
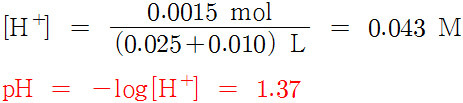
3) NaOH 25 mL 加 (중화점) ... 25 mL는 가한 전체 부피
가한 NaOH의 mol수는
(0.1 mol/L) × 0.025 L = 0.0025 mol
(처음) 산의 몰수와 (가한) 염기의 몰수가 같으므로,
시료인 산은 표준 용액인 염기에 의해 완전히 중화된다. 따라서,
pH = 7
---> 강산-강염기 적정의 중화점(= 당량점)에서의 용액의 pH
4) NaOH 35 mL 加
가한 NaOH의 mol수는
(0.1 mol/L) × 0.035 L = 0.0035 mol
---> 염기는 산을 완전히 중화시키고도 남는다. 얼마만큼?
0.0035 – 0.0025 = 0.001 mol
이때 NaOH의 몰농도와 용액의 pH는 다음과 같다.
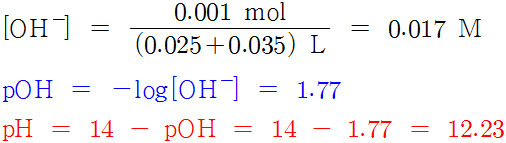
※ 강산-강염기 적정의 경우,
생성된 염(NaCl)의 가수분해가 없으므로, 계산이 간단하다.
---------------------------------------------------
실제 적정 실험할 때는 중화점 부근에서는 표준 용액을 한 방울씩 가한다.
일반적으로 뷰렛에서 떨어지는 용액 한 방울의 부피는 0.03~0.05 mL 정도이며,
중화점 직전에서는 시료 용액의 색깔이 잠시 변했다가 다시 원래대로 되돌아간다.
그러다가 어느 순간 단 한 방울에 의해 시료 용액의 색깔은 완전히 변해 버린다.
[실험 팁] 실제 적정 실험에서는 정확한 중화점을 모르기 때문에,
중화점을 지나칠때까지, 즉 용액의 색깔이 완전히 변할때까지
한번에 표준용액을 2~3 mL 정도씩 확(왕창) 가해서
대략적인 중화점을 찾은 다음, 본 실험에 들어간다.
실제 실험과 유사하게
첨가한 표준 용액의 양 vs. 용액의 pH 값을 나타낸
도표와 그래프를 만들어보았다.
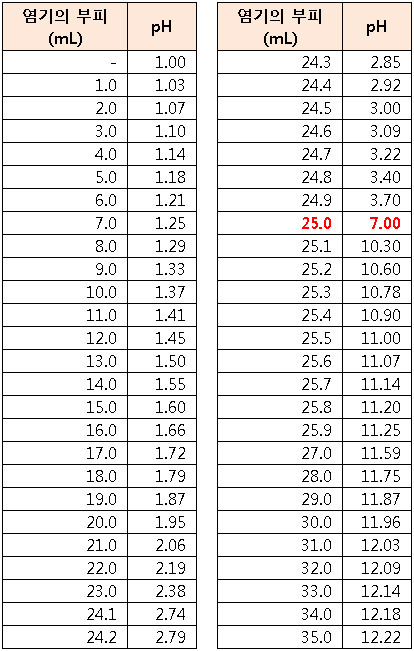
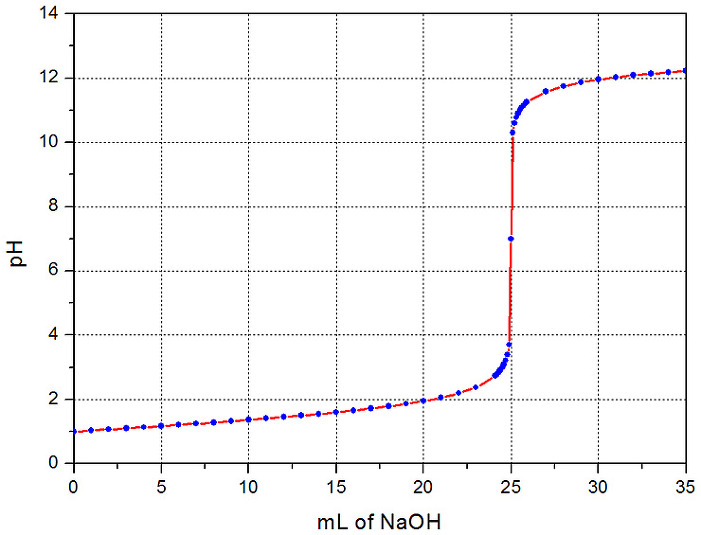
적정 그래프를 오리진(Origin) 또는 시그마플롯(SigmaPlot) 등의
그래프 작성 프로그램을 이용해서 미분하면,
다음과 같이 중화점에서의 표준 용액의 정확한 부피(변곡점)를 구할 수 있다.
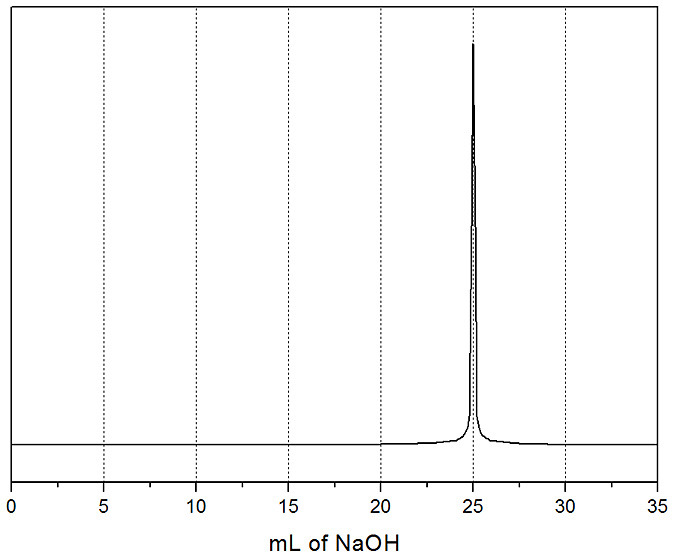
실험에서는 시료 용액의 농도를 모른다.
그럼 어떻게 구할까?
실험 전 아는 자료는 다음과 같다.
① 시료의 부피, V1
② 표준 용액의 몰농도, M2
적정 실험을 통해 구한 자료는 다음과 같다.
③ 중화점에서의 표준 용액의 부피, V2
위 값들을 다음 식에 대입하면 시료의 몰농도(M1)를 구할 수 있다.
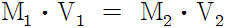
( 참고 https://ywpop.tistory.com/4689 )
예를 들어, 시료 25 mL를 피펫으로 분취하여 삼각플라스크에 넣고,
0.1 M 표준 용액을 뷰렛에 넣고 적정 실험을 한 결과,
중화점(변색점, 종말점)에서 소비된 표준 용액의 부피가 37.5 mL라면,
M1 × 25 mL = 0.1 M × 37.5 mL
M1 = 0.1 × 37.5 / 25 = 0.15 M
[참고]
적정 곡선을 보면 중화점에서의 기울기가 거의 수직에 가깝다.
이 때문에 시료 용액의 변색을 통해 실험적으로 결정한 중화점인 종말점이
중화 반응이 완결된 실제 중화점과 거의 같다고 가정한다.
( 중화점 부근에서 pH가 급격히(거의 수직적으로) 변하기 때문에,
즉, 단 한 방울의 표준용액에 의해 종말점이 결정되기 때문에,
“종말점 ≒ 중화점” 이라 간주한다. )
단 한 방울의 표준 용액에 의해 중화 반응이 완결되기 때문에,
즉 시료 용액이 완전 변색되기 때문에
실수로 표준 용액이 한 두 방울 더 들어가더라도
시료 용액의 농도 결정에 큰 영향을 주지 않는다.
앞의 실험에서, 만약 두 방울 더 들어갔다고 치면,
표준 용액의 소비량은 37.6 mL가 되고,
계산된 시료 용액의 농도는 0.1504 M이 된다.
이처럼 중화 적정 실험은
간단한 실험으로 시료 용액의 농도를 비교적 정확히 구할 수 있는 방법이다.
[적정 곡선에서, 중화점 부근에서 기울기가 급격하게 변하는 이유는?]
중화점(당량점) 부근에서는 추가되는 OH^-(또는 H^+)와
중화 반응할 수 있는 H^+(또는 OH^-)의 mol수가 작기 때문입니다.
예를 들어, H^+가 100개 있을 때 OH^-를 1개 넣는 것과,
OH^-를 1개씩 계속해서 넣어서 대부분의 H^+가 OH^-와 반응하여 물이 되고,
이제 겨우 H^+가 3~4개 있을 때 OH^-를 1개 넣는 것 중,
어느 것이 OH^-를 넣은 효과가 더 클까요?를 생각해보세요.
[ 관련 글 https://ywpop.tistory.com/7071 ] 곡선이 급변하는 이유는 log 함수 때문이다.
[ 관련 예제 https://ywpop.tistory.com/search/강산-강염기%20적정 ] 강산-강염기 적정
[참고] 오리진에서 변곡점 구하기
[ Analysis > Calculus > Differentiate ]
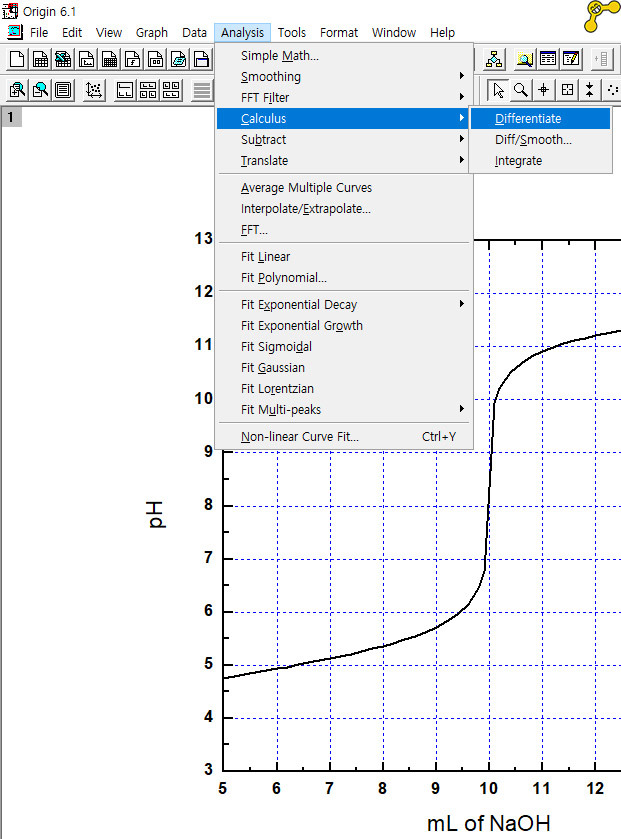
[ 참고: 적정 그래프 https://saylordotorg.github.io/text_general-chemistry-principles-patterns-and-applications-v1.0/s20-05-acid-base-titrations.html ]
[키워드] 중화 적정 곡선 기준, 강산-강염기 적정 기준, 중화 적정 곡선 사전, 강산-강염기 적정 사전, 산-염기 적정 경전, 산-염기 중화 적정 경전
'일반화학 > [17장] 수용액 평형의 다른 관점' 카테고리의 다른 글
| 0.1 M CH3COOH 50 mL + 0.1 M NaOH. 당량점 pH (2) | 2014.11.03 |
|---|---|
| N2H4-N2H5Cl 완충 용액 (buffer system) (0) | 2014.10.20 |
| 산-염기 중화 적정 과정에서 용액의 pH 계산: 약염기-강산 적정 (3) | 2014.08.11 |
| 산-염기 중화 적정 과정에서 용액의 pH 계산: 약산-강염기 적정 ★ (2) | 2014.08.08 |
| 산-염기 적정. 산-염기 중화 적정 ★ (0) | 2014.07.30 |
| [공통 이온 효과] 공통 이온이 존재할 때, pH 계산 (0) | 2014.07.28 |
| 공통 이온 효과 (common ion effect) (0) | 2014.07.28 |
| 특정 pH 값을 갖는 완충용액의 제조, Henderson-Hasselbalch 식 ★ (13) | 2012.09.15 |




댓글