0.1 M NH3 용액의 pH. ICE 도표로 계산
0.1 M 암모니아 용액의 pH
0.1 M 암모니아 용액의 pH는 얼마인가?
단, Ka = 5.70×10^(-10)
---------------------------------------------------
Kb값 대신 Ka값이 주어졌기에,
먼저 Kb값을 구해야 한다.
Kb값은 다음 관계식으로부터 구할 수 있다.
Kw = Ka × Kb
( 참고 https://ywpop.tistory.com/2937 )
Kb = Kw / Ka
= (10^(-14)) / (5.70×10^(-10))
= 1.75×10^(-5)
암모니아는 물에서 다음과 같이 이온화된다.
NH3(aq) + H2O(l) ⇌ NH4^+(aq) + OH^-(aq)
이 평형 반응을 ICE(초기-변화-평형) 도표로 나타내면,
( 용매인 물은 생략. )
| NH3(aq) | ⇌ | NH4^+(aq) | + | OH^-(aq) | |
| 초기(M): | 0.1 | 0 | 0 | ||
| 변화(M): | –x | +x | +x | ||
| 평형(M): | 0.1–x | x | x |
이 평형 반응을 염기 이온화 상수, Kb로 나타내면,
Kb = [NH4^+] [OH^-] / [NH3]
= (x) (x) / (0.1–x) = 1.75×10^(-5)
( 참고 https://ywpop.tistory.com/4294 )
암모니아는 약염기이므로,
평형에서 OH^- 농도인 x 값이 매우 작다고 가정하면,
0.1–x ≒ 0.1 로 근사적으로 처리할 수 있다.
(x) (x) / (0.1) = 1.75×10^(-5)
x = [(1.75×10^(-5)) (0.1)]^(1/2)
= 0.00132 M OH^-
pOH = –log[OH^-]
= –log(0.00132) = 2.88
pH + pOH = 14 이므로,
pH = 14 – pOH = 11.12
답: pH = 11.12
[ 관련 예제 https://ywpop.tistory.com/8304 ] 0.1 M NH3 용액의 pH
[ 관련 글 https://ywpop.tistory.com/23831 ] 약염기 용액의 pH 계산 공식
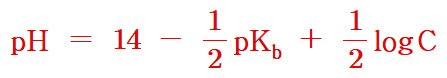
[키워드] 암모니아 용액의 pH 기준문서, NH3 용액의 pH 기준문서, NH3의 pH 기준문서, 암모니아의 pH 기준문서, 암모니아 용액의 pH 사전, NH3 용액의 pH 사전, ICE 도표로 pH 계산 기준문서
'일반화학 > [16장] 산-염기 평형' 카테고리의 다른 글
| 3가지 인의 산소산의 세기. H3PO2, H3PO3, H3PO4 (2) | 2015.08.28 |
|---|---|
| CaCl2 수용액의 pH(산도)는 산성 (2) | 2015.08.10 |
| 0.2 M HCl 50 mL + 0.1 M NaOH 50 mL 용액의 pH는 1.3 (2) | 2015.07.15 |
| 다양성자성 산. 2양성자성산과 3양성자성산 (1) | 2015.06.28 |
| 크기가 작고 전하가 큰 금속 양이온과 물의 가수분해 반응 (1) | 2014.12.05 |
| 약산의 초기 농도와 Ka로부터 pH 구하기 예제 (6) | 2014.11.13 |
| 약산 ascorbic acid 용액의 pH. 250 mg / 250 mL (10) | 2014.11.03 |
| 약산의 Ka와 짝염기의 Kb 사이의 관계식, conjugate acid-base pairs ★ (1) | 2014.10.30 |

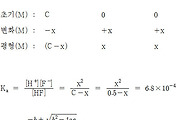
댓글