728x170
3가지 인의 산소산의 세기. H3PO2, H3PO3, H3PO4
Acidity of oxoacid of phosphorus
3가지 산소산 모두 단 1개의 홀로 있는 산소 원자(free O atom),
즉 3가지 산소산 모두 단 1개의 P=O 결합을 갖고 있기 때문에,
산의 세기는 비슷할 것으로 예상된다.
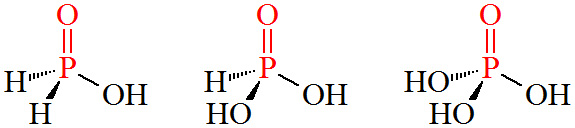
그러나 3가지 산소산의 산의 세기는 다르며,
이것은 3가지 산소산의 짝염기로 설명할 수 있다.
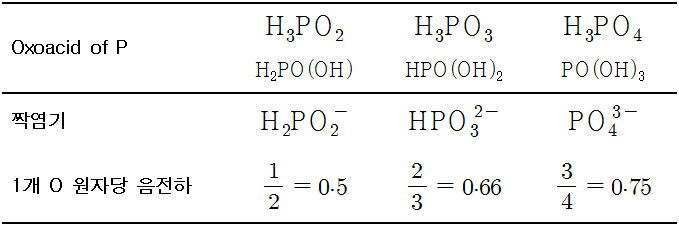
산소(O) 원자당 음전하가 클수록,
음이온(짝염기)과 수소 양이온(H^+) 사이에는
더 강한 정전기적 인력이 작용한다.
이로 인해, 산의 이온화는 감소하며,
그 결과 약산이 된다.
따라서
산의 세기는 다음과 같이 차이가 난다.
| H3PO2 | > | H3PO3 | > | H3PO4 | |
| pKa | 1.2 | 1.8 | 2.15 |
---> H3PO2가 가장 강산이고, H3PO4가 가장 약산이다.
[키워드] 인의 산소산의 세기 기준, 인산의 세기 기준, 인의 산소산의 세기 사전, 인산의 세기 사전, 인산의 Ka 기준, 인산의 pKa 기준
반응형
그리드형(광고전용)
'일반화학 > [16장] 산-염기 평형' 카테고리의 다른 글
| 약산 0.060 M 용액의 pH가 3.44일 때, Ka 계산 (0) | 2015.10.18 |
|---|---|
| 약산(CH3COOH) <- 강염기(NaOH) 중화 적정. 적정 중 용액의 pH (0) | 2015.10.17 |
| 0.01 M HCl 용액과 0.10 M KOH 용액의 pH (0) | 2015.10.14 |
| 0.01 M 암모니아 수용액의 이온화도는 4.3% (0) | 2015.10.05 |
| CaCl2 수용액의 pH(산도)는 산성 (2) | 2015.08.10 |
| 0.2 M HCl 50 mL + 0.1 M NaOH 50 mL 용액의 pH는 1.3 (2) | 2015.07.15 |
| 다양성자성 산. 2양성자성산과 3양성자성산 (1) | 2015.06.28 |
| 0.1 M NH3 용액의 pH. ICE 도표로 계산 ★ (0) | 2015.06.12 |
댓글