약산의 Ka와 짝염기의 Kb 사이의 관계식. conjugate acid-base pairs
A. 약산의 화학 평형과 Ka (acid dissociation constant)

B. (약산의) 짝염기의 화학 평형과 Kb (base dissociation constant)

[주의] B)의 CH3COO^- 이온은 A)에 나오는 CH3COO^- 이온이 아니다.
CH3COONa(aq) → Na^+(aq) + CH3COO^-(aq)
( 관련 글 https://ywpop.tistory.com/7215 )
( 위 반응은 염기 이온화 반응이자, 또한 가수분해 반응이다. )
( 염기 이온화 상수, Kb = 가수분해 상수, Kh )
C. 약산의 Ka와 짝염기의 Kb 사이의 관계식 (conjugate acid-base pairs)

Kw가 상수이기 때문에,
⇨ 강한 산(큰 Ka 값)의 짝염기는 약한 염기(작은 Kb 값)이고,
약한 산의 짝염기는 강한 염기이다.
⇨ 강한 염기(큰 Kb 값)의 짝산은 약한 산(작은 Ka 값)이고,
약한 염기의 짝산은 강한 산이다.
( 한번 더 설명 https://ywpop.blogspot.com/2024/02/blog-post_28.html )
[표] 짝산-짝염기 쌍 (conjugate acid-base pairs)

약염기(ammonia)와 짝산(ammonium) 사이의 관계식
A. 약염기의 화학 평형과 Kb (base dissociation constant)
NH3(aq) + H2O(l) ⇌ NH4^+(aq) + OH^-(aq)
Kb = [NH4^+] [OH^-] / [NH3]
B. (약염기의) 짝산의 화학 평형과 Ka (acid dissociation constant)
NH4Cl(aq) → NH4^+(aq) + Cl^-(aq)
NH4^+(aq) + H2O(l) ⇌ NH3(aq) + H3O^+(aq)
Ka = [NH3] [H3O^+] / [NH4^+]
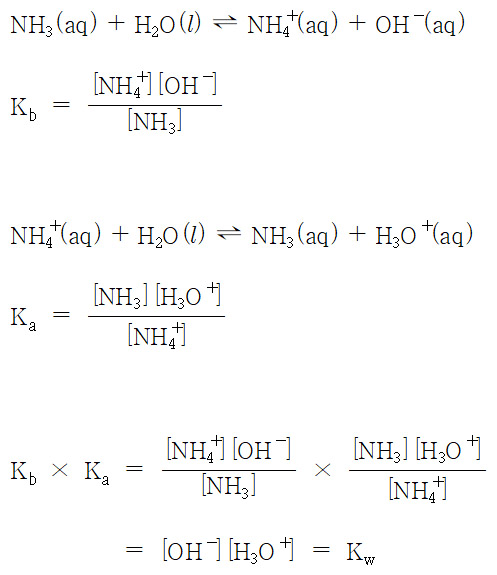
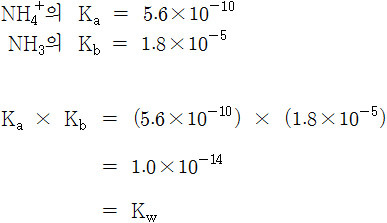
Kw = Ka × Kb = 1.0×10^(-14)
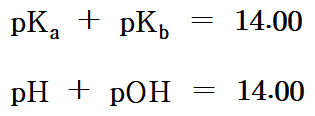
> pKa + pKb = 14.00
> pH + pOH = 14.00
[ 관련 글 https://ywpop.tistory.com/2700 ] 짝산-짝염기 쌍
[ 관련 글 https://ywpop.tistory.com/2704 ] 물의 이온곱 상수, Kw
Kw = [H^+] [OH^-] = 1.0×10^(-14)
[ 참고: 평형상수 식 https://ywpop.tistory.com/7136 ]
[키워드] Ka × Kb 기준문서, Ka * Kb 기준문서, Ka×Kb 기준문서, Ka*Kb 기준문서, 짝산 짝염기 세기 기준문서, 짝산-짝염기 세기 기준문서, Kw = Ka × Kb 기준문서, Ka × Kb = Kw 기준문서, 약산의 짝염기 기준문서, 약염기의 짝산 기준문서, Ka Kb = Kw 기준문서, Ka와 Kb의 관계 기준문서, Ka와 Kb 기준문서, pKa + pKb 기준문서, Ka * Kb dic, Ka*Kb dic, 짝산 짝염기 도표 기준문서, 짝산 짝염기 사전, Ka × Kb = Kw dic, Ka × Kb = Kw 사전, 약산의 짝염기는 강염기 기준, 약염기의 짝산은 강산 기준, 약산의 짝염기는 강염기 사전, 약염기의 짝산은 강산 사전
---------------------------------------------------
▶ 약산의 짝염기는 강염기
= 약산의 짝염기는 비교적 강한 염기
---> NaOH와 같은 레벨의 강염기라는 말이 아니다.
---> 물보다 강한 염기라는 뜻이다.
---> 약산의 짝염기는 물과 가수분해 반응이 일어난다.
( 약산의 짝염기는 양성자 받게 염기, 물은 양성자 주게 산. )
[ 관련 글 https://ywpop.tistory.com/6264 ] 약산의 짝염기는 강염기? 이 표현의 의미를 제대로 알자.
▶ 약염기의 짝산은 강산
= 약염기의 짝산은 비교적 강한 산
---> HCl과 같은 레벨의 강산이라는 말이 아니다.
---> 물보다 강한 산이라는 뜻이다.
---> 약염기의 짝산은 물과 가수분해 반응이 일어난다.
( 약염기의 짝산은 양성자 주게 산, 물은 양성자 받게 염기. )
'일반화학 > [16장] 산-염기 평형' 카테고리의 다른 글
| 0.1 M NH3 용액의 pH. ICE 도표로 계산 ★ (0) | 2015.06.12 |
|---|---|
| 크기가 작고 전하가 큰 금속 양이온과 물의 가수분해 반응 (1) | 2014.12.05 |
| 약산의 초기 농도와 Ka로부터 pH 구하기 예제 (6) | 2014.11.13 |
| 약산 ascorbic acid 용액의 pH. 250 mg / 250 mL (10) | 2014.11.03 |
| pH 11.17인 NH3 용액의 몰농도 (0) | 2014.10.16 |
| pH 값, 산도의 측정 ★ (5) | 2014.07.25 |
| 물의 자동이온화와 이온곱 상수, Kw ★ (4) | 2014.07.24 |
| 양쪽성양성자성(amphiprotic) 물질 ★ (2) | 2014.07.24 |




댓글