크기가 작고 전하가 큰 금속 양이온과 물의 가수분해 반응
---------------------------------------------------
▶ 참고: 제16장 산-염기 평형. 목차
[ https://ywpop.tistory.com/15336 ]
---------------------------------------------------
예) AlCl3
⇨ 크기가 작고 전하가 큰 금속 양이온(Al^3+)과
강산의 짝염기(Cl^-)로 이루어진 염은
산성 용액을 만든다.
(1) AlCl3를 물에 용해시키면, 다음과 같이 이온화된다.
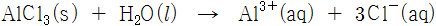
AlCl3(s) + H2O(l) → Al^3+(aq) + 3Cl^-(aq)
(2) 이때 생성된 Al^3+ 이온은
물 분자 6개가 수화된 형태, [Al(H2O)6]^3+로 존재한다.
(3) [Al(H2O)6]^3+ 이온과 물 사이에 가수분해 반응이 일어난다.
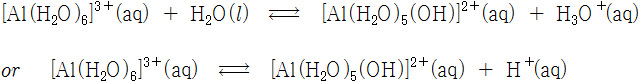
---> 가수분해 결과, 생성된 H^+ 이온 때문에 산성 용액을 만든다.

[ 그림 출처 2012books.lardbucket.org ]
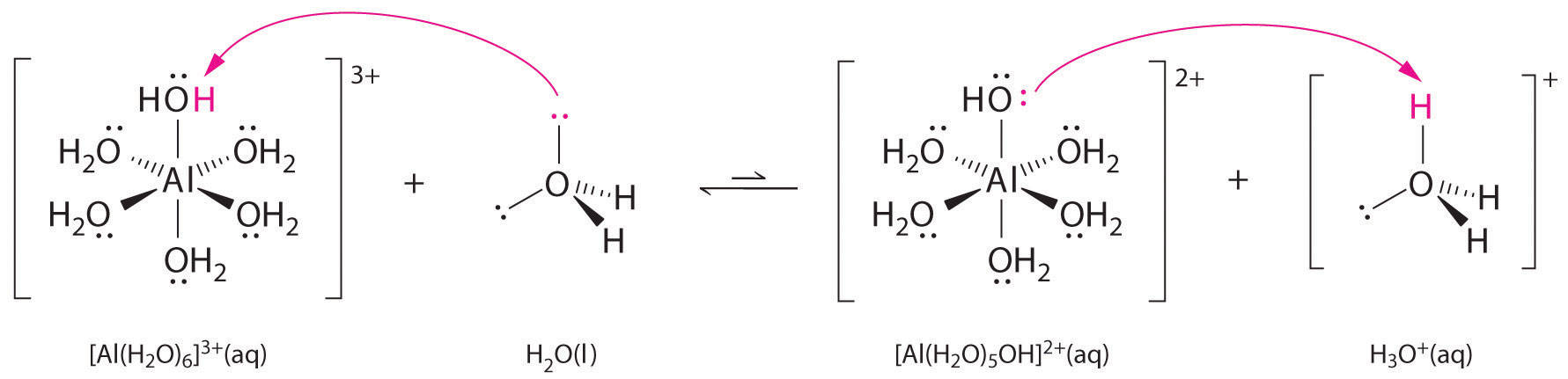
(a) Reaction of the metal ion Al^3+ with water to form the hydrated metal ion is an example of a Lewis acid-base reaction. (b) The positive charge on the aluminum ion attracts electron density from the oxygen atoms, which shifts electron density away from the O–H bonds. The decrease in electron density weakens the O–H bonds in the water molecules and makes it easier for them to lose a proton.
크기가 작고 전하가 큰 금속 양이온(Al^3+)이
( Al^3+ 이온의 전하 밀도는 높다. 그래서 양전하가 세다, 강하다. )
수화된 물 분자의 결합 전자들을 강하게 끌어당긴다.
이 때문에 물 분자의 전자 밀도는 감소되고,
이것은 물 분자의 원자간 (공유) 결합력을 약화시킨다.
---> 수화된 물 분자의 수소 원자는 잘 떨어져 나간다.
---> 가수분해 반응이 일어난다.
[ 그림 출처 2012books.lardbucket.org ]
[ 관련 글 https://ywpop.tistory.com/16735 ] amphoteric [Al(H2O)3(OH)3]
[Al(H2O)6]^3+(aq) + H2O(l) ⇌ [Al(H2O)5OH]^2+(aq) + H3O^+(aq)
[Al(H2O)4(OH)2]^+(aq) + H2O(l) ⇌ [Al(H2O)3(OH)3](s) + H3O^+(aq)
[Al(H2O)3(OH)3](s) + H2O(l) ⇌ [Al(H2O)2(OH)4]^-(aq) + H3O^+(aq)
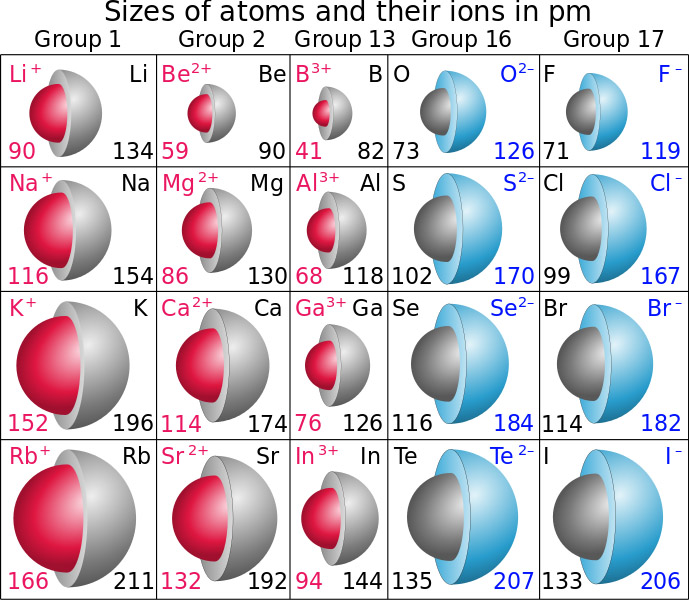
[ 그림 출처 Wikimedia ] Radii of some elements as neutral atoms, and cations (red) and anions (blue) derived from those atoms. Radii are given in picometers.
[도표] 25℃ 수용액에서, 금속 양이온의 산 이온화 상수
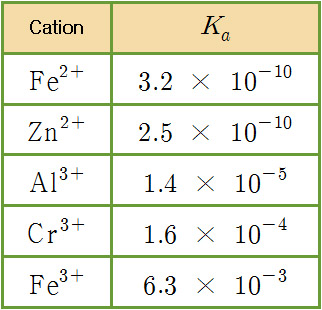
> 약산인 acetic acid, CH3COOH의 Ka = 1.8×10^(-5)
▶ Greater charge and smaller size make a cation more acidic.
▶ Metal aqua ions display varying pKa values
that are dependent on size and charge.
1) The smaller the metal ion, the more acidic it will be.
2) The higher the charge on metal ions of about the same size,
the more acidic will the metal ion be.
[참고] 가수분해 반응
수화된 금속 이온의 가수분해 반응은
[Al(H2O)6]^3+(aq) + H2O(l) ⇌ [Al(H2O)5OH]^2+(aq) + H3O^+(aq)
약산/약염기의 이온화 반응처럼,
극히 일부만 일어나는 평형 반응(⇌)이다.
[Al(H2O)6]^3+(aq) + H2O(l) ←←←→ [Al(H2O)5OH]^2+(aq) + H3O^+(aq)
[참고] 산-염기 반응
Al(OH)3(aq) + 3H^+(aq) → Al^3+(aq) + 3H2O(l)
( 참고 https://ywpop.blogspot.com/2023/10/hcl-aloh3.html )
[참고] Metal aquo complexes
Metal aquo complexes are coordination compounds
containing metal ions with only water as a ligand.
( 링크 https://en.wikipedia.org/wiki/Metal_aquo_complex )
[키워드] 염화 알루미늄, AlCl3, 수화된 알루미늄 이온 기준문서, 수화된 알루미늄 3가 이온, 수화된 알루미늄 +3가 이온, 전하가 크고 크기가 작은 금속 이온의 가수분해, 크기가 작고 전하가 큰 금속 이온의 가수분해, 크기가 작고 기준문서, 크기가 작고 이온전하가 높은 기준문서, 16장 산-염기 평형, [Al(H2O)6]^3+ 기준문서, 크기가 작고 사전
'일반화학 > [16장] 산-염기 평형' 카테고리의 다른 글
| CaCl2 수용액의 pH(산도)는 산성 (2) | 2015.08.10 |
|---|---|
| 0.2 M HCl 50 mL + 0.1 M NaOH 50 mL 용액의 pH는 1.3 (2) | 2015.07.15 |
| 다양성자성 산. 2양성자성산과 3양성자성산 (1) | 2015.06.28 |
| 0.1 M NH3 용액의 pH. ICE 도표로 계산 ★ (0) | 2015.06.12 |
| 약산의 초기 농도와 Ka로부터 pH 구하기 예제 (6) | 2014.11.13 |
| 약산 ascorbic acid 용액의 pH. 250 mg / 250 mL (10) | 2014.11.03 |
| 약산의 Ka와 짝염기의 Kb 사이의 관계식, conjugate acid-base pairs ★ (1) | 2014.10.30 |
| pH 11.17인 NH3 용액의 몰농도 (0) | 2014.10.16 |

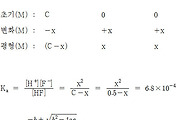
댓글