표준생성엔탈피를 이용한 표준반응엔탈피의 계산
standard enthalpy of formation and the heat(enthalpy) of reaction
생성엔탈피로 반응엔탈피 계산
---------------------------------------------------
▶ 참고: 제5장 열화학. 목차
[ https://ywpop.tistory.com/15205 ]
---------------------------------------------------
문헌에 나와 있는 생성엔탈피(enthalpy of formation) 값을 이용하여,
반응엔탈피(enthalpy of reaction)를 계산할 수 있다.
( 참고: 표준생성엔탈피의 정의 https://ywpop.tistory.com/4416 )

ΔH°_rxn = [생성물들의 ΔH°_f 합] – [반응물들의 ΔH°_f 합]
( 참고 https://ywpop.tistory.com/3431 )
---------------------------------------------------
[예제] Propane, C3H8의 연소열 계산
Calculate the heat of combustion of propane, C3H8.

ΔH°_rxn = [생성물들의 ΔH°_f 합] – [반응물들의 ΔH°_f 합]
= [3×ΔH°_f(CO2,g) + 4×ΔH°_f(H2O,l)] – [1×ΔH°_f(C3H8,g) + 5×ΔH°_f(O2,g)]
= [3×(–393.5) + 4×(–285.8)] – [1×(–103.85) + 5×(0)]
= –2219.9 kJ
---> C3H8 1 mol에 대한 연소열이므로,
= –2219.9 kJ/mol
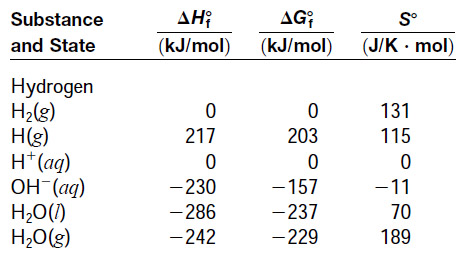
[그림] H2O의 열역학 자료.
일반화학 교재 부록에서 이와 같은 자료를 찾아서 계산한다.
( 참고: 줌달 일반화학 8판 부록 )
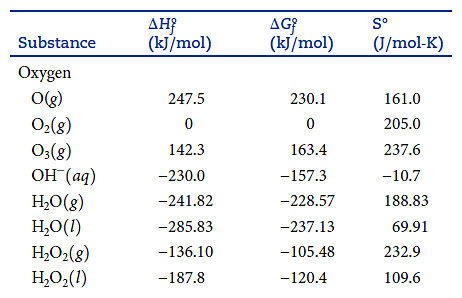
( 참고: Brown외 일반화학 13판 부록 )
※ 물리화학적 상수 값은 문헌마다 다소 차이날 수 있다는 것을 잊지 말 것.
[참고] 반응 엔탈피, ΔH°_rxn의 단위는 kJ (kJ/mol이 아니다.)
각 물질의 생성 엔탈피, ΔH°_f의 단위는 kJ/mol 인데,
생성물들 또는 반응물들의 ΔH°_f 합을 구할 때
각 물질의 계수(= 몰수) × 각 물질의 ΔH°_f 이므로,
즉, mol × (kJ/mol) = kJ 이므로,
ΔH°_rxn 계산 결과의 단위는 kJ이다.
단, C3H8의 연소열 계산에서와 같이,
반응한(연소된) 물질의 몰수가 1 mol인 경우,
그 물질에 대한 ΔH°_rxn의 단위는 kJ/mol도 가능하다.
[ 표준생성엔탈피 자료 https://en.wikipedia.org/wiki/Standard_enthalpy_of_formation ]
[ 관련 글 https://ywpop.tistory.com/13107 ] 반응 엔탈피를 계산하는 2가지 방법
▶ ΔH°_rxn, 반응 엔탈피 공식 [ https://ywpop.tistory.com/3431 ]
▶ ΔS°_rxn, 반응 엔트로피 공식 [ https://ywpop.tistory.com/7404 ]
▶ ΔG°_rxn, 반응 자유에너지 공식 [ https://ywpop.tistory.com/7393 ]
▶ ΔG = ΔH – TΔS 공식 [ https://ywpop.tistory.com/7438 ]
▶ ΔH, ΔS, ΔG 계산 예제 [ https://ywpop.tistory.com/16663 ]
[키워드] 생성엔탈피로 반응엔탈피 계산 기준문서, 표준생성엔탈피로 표준반응엔탈피 계산 기준문서, 표준 반응 엔탈피 기준문서, 표준 반응 엔탈피 계산 기준문서, 생성엔탈피로 반응엔탈피 계산 사전, C3H8의 연소열 계산 기준문서, 프로판의 연소열 계산 기준문서, 프로페인의 연소열 계산 기준문서
'일반화학 > [05장] 열화학' 카테고리의 다른 글
| ΔH 계산. C2H6(g)의 표준생성엔탈피. 에테인의 표준생성엔탈피 (0) | 2015.06.30 |
|---|---|
| 25.0℃ water 50.0 g NaOH 8.00 g water 250.0 g HCl 8.00 g 33.5℃ (3) | 2015.05.25 |
| 0.600 M HNO3 + 0.300 M Ba(OH)2 18.46℃ (3) | 2015.05.20 |
| 325 J/℃ 0.900 M HCl 85.0 mL 0.900 M KOH 85.0 mL 18.24℃ (5) | 2015.05.20 |
| 헤스 법칙, Hess’s law ★ (1) | 2015.05.02 |
| 0℃에서 500 mL의 물이 얼음으로 전환될 때 엔탈피 변화량 (0) | 2014.12.15 |
| 커피컵 열량계를 사용한 ΔH 측정. HCl + NaOH 중화열 측정 ★ (0) | 2014.11.30 |
| 반응열과 반응엔탈피의 관계 (0) | 2014.11.18 |
댓글