금속의 활동도 계열. Activity Series of Metals
Reactivity Series of Metals
---------------------------------------------------
▶ 참고: 제4장 수용액 반응. 목차
[ https://ywpop.tistory.com/15191 ]
---------------------------------------------------
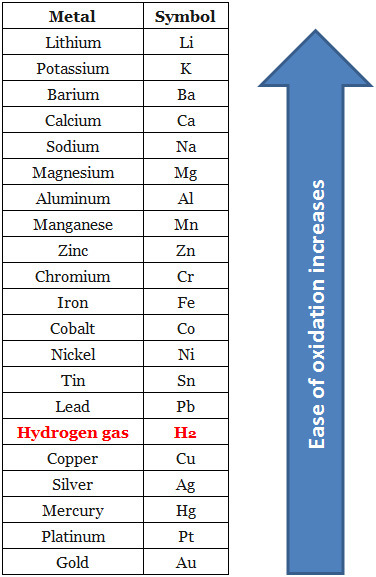
[그림] 금속의 활동도 계열.
> 도표에서 가장 산화가 잘 되는 물질은 Li. Li은 반응성이 가장 높은 물질.
> 도표에서 가장 산화가 안 되는 물질은 Au. Au는 반응성이 가장 낮은 물질.
[참고] Ag와 Hg의 순서는 대학 일반화학 교재에서는 Ag > Hg 로 나오고,
인터넷에서 검색하면 Hg > Ag 로 나오므로, 각자의 교재에서 확인해 볼 것.
▶ MCMURRY 일반화학 6판
[TABLE 4.5] A Partial Activity Series of the Elements
Cu > Ag > Hg > Pt > Au
▶ Brown외 일반화학 13판
[Table 4.5] Activity Series of Metals in Aqueous Solution
Cu > Ag > Hg > Pt > Au
---------------------------------------------------
▶ 금속의 산화 용이성을 나열한 도표
▶ 전기화학적 실험 결과를 정리한 것 (이론적으로 설명 불가)
( 참고: 금속의 활동도 계열과 피파 순위 https://ywpop.tistory.com/12557 )
( 참고: 표준 수소 전극 https://ywpop.tistory.com/8305 )
▶ 어떤 금속을 산 수용액 또는 금속 염 수용액에 넣었을 때,
반응이 일어날지 여부는 활동도 계열 도표를 보고 예측할 수 있다.
▶ 예를 들어, A 금속으로 이루어진 염(AX) 수용액에 어떤 B 금속을 넣었을 때,
AX(aq) + B(s) →
① 반응이 일어났다, 어떤 변화가 관찰되었다.
---> A보다 B의 반응성이 더 크다.
---> B가 활동도 서열이 더 높다. B가 이온화 경향성이 더 크다.
② 반응이 일어나지 않았다, 어떤 변화도 관찰되지 않았다.
---> B보다 A의 반응성이 더 크다.
---> A가 활동도 서열이 더 높다. A가 이온화 경향성이 더 크다.

Q) Ag 금속을 Cu(NO3)2 수용액에 넣으면 어떻게 될까?
A) 아무 변화도 일어나지 않는다.
▶ 도표의 위쪽에 있는 금속(Li, K)은 쉽게 산화하기 때문에,
⇨ 활성 금속 (active metal)
▶ 아래쪽에 있는 금속(Ag 이하 Pt, Au)은 잘 반응하지(변하지) 않기 때문에,
⇨ 귀금속 (noble metal)
( 화학에서 noble은 비활성, 즉 반응성이 거의 없다는 뜻임. cf.: noble gas )
▶ 활성 금속은 화학적으로 불안정하기 때문에 (또는 반응성이 높기 때문에),
자연 상태에서 대부분 화합물 형태로 존재한다.
▶ 귀금속은 화학적으로 안정하기 때문에 (또는 반응성이 낮기 때문에),
자연 상태에서도 안정적으로 원소 상태로 존재한다.
▶ 이와 비슷한 개념
⇨ 금속의 이온화 경향(서열)
외우는 방법: 칼카나마 / 알아철 / 니주납 (수소) 구수은백금
K > Ca > Na > Mg > Al > Zn > Fe >
Ni > Sn > Pb > (H) > Cu > Ag > Hg > Pt > Au
( 단, 고등학교 교재에서는 Hg > Ag 순서임 )
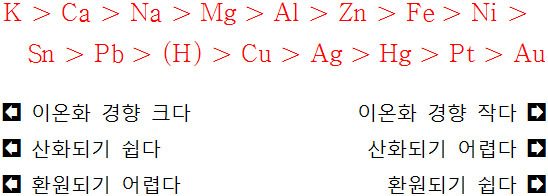
[그림] ionization tendency of metal.
[참고]
금속은 누구라도 이온으로 존재하고 싶어 합니다.
( 참고 https://ywpop.tistory.com/2904 )
이 때문에 다툼이 있을 수 있기에,
조물주가 각 금속마다 서열을 매겨 주었습니다.
( 어떤 기준으로 서열을 정했는지는 오로지 조물주만 암. )
이것이 “금속의 이온화 서열(= 경향)”입니다.
어떤 금속과 다른 금속 이온이 만났을 때
금속의 서열이 더 높으면 그 금속은 이온이 될 수 있고,
( 이때 상대방 금속 이온은 금속으로 환원됩니다. )
이온의 서열이 더 높으면 그 이온은 계속 이온으로 존재할 수 있습니다.
( 이럴 경우, 아무런 변화가 일어나지 않습니다. )
예를 들어, Mg^2+ 이온과 Al 금속이 만나면,
서열이 Mg > Al 이므로,
Mg^2+ 이온은 그대로 이온 상태를 유지합니다.
( 화학 반응 일어나지 않음. 변화 없음. )
[금속의 이온전하(산화수). 금속의 이온식]
K^+
Ca^2+
Na^+
Mg^2+
Al^3+
Zn^2+
Fe^2+, Fe^3+
Ni^2+, Ni^3+
Sn^2+, Sn^4+
Pb^2+, Pb^4+
(H)
Cu^+, Cu^2+
Hg^+, Hg^2+
Ag^+
Pt^2+, Pt^4+
Au^+, Au^3+
( 참고: 주기율표 암기 https://ywpop.tistory.com/4841 )
( 참고: 전이금속의 산화수 https://ywpop.tistory.com/2959 )
[ 관련 예제 https://ywpop.tistory.com/8014 ] 금속과 묽은 염산의 반응 여부는 어떻게 판단하는가?
[ 관련 글 https://ywpop.tistory.com/15518 ] 금속의 이온화 경향에 비금속인 수소가 포함된 이유
[ 관련 글 https://ywpop.tistory.com/6563 ] 할로겐 원소의 활성도 순서
[ 관련 글 https://ywpop.tistory.com/7027 ] [도표] 표준환원전위
[ 관련 글 https://ywpop.tistory.com/11389 ] 전기화학 (electrochemistry) 목차
[ 관련 글 https://ywpop.blogspot.com/2024/07/oxidizing-ability-and-reducing-ability.html ]
oxidizing power and reducing power. 산화력 환원력. 산화능 환원능
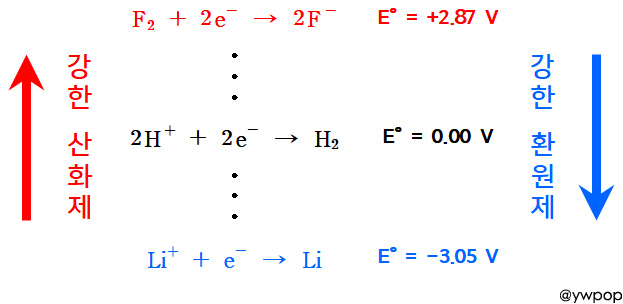
[키워드] 활동도계열 기준, 이온화서열 기준, 이온화경향 기준, 이온화 경향성 기준, 이온화순서 기준, 귀금속 기준, 활동도계열 사전, 이온화서열 사전, 이온화경향 사전, 이온화 경향성 사전, 이온화순서 사전, 귀금속 사전
'일반화학 > [04장] 수용액 반응' 카테고리의 다른 글
| 산화-환원 반응에서, 산화제, 환원제 찾기 (0) | 2015.08.17 |
|---|---|
| Mg(OH)2 침전. 0.200 M KOH + 0.200 M Mg(NO3)2 (1) | 2015.07.27 |
| 구연산과 탄산수소나트륨의 반응. 구연산과 베이킹소다의 반응 (1) | 2015.06.20 |
| 알짜이온반응식. Na2CO3 + CaCl2. CaCO3 침전 (3) | 2015.04.07 |
| 산소의 득실과 산화-환원 반응의 동시성 ★ (0) | 2014.11.25 |
| 원자단이 있는 이온결합 화합물의 산화수 구하기 (0) | 2014.11.14 |
| 화학 반응에서 염(salt)이란 (0) | 2014.11.13 |
| 산화-환원 반응에서 불균등화 반응 ★ (0) | 2014.11.08 |




댓글