깁스 자유 에너지(Gibbs free energy), ΔG = ΔH – TΔS 식의 부호
반응 온도에 따른 ΔG의 부호. 반응 온도와 ΔG의 부호
반응 온도에 따른 자발적 반응. 반응 온도와 자발적 반응
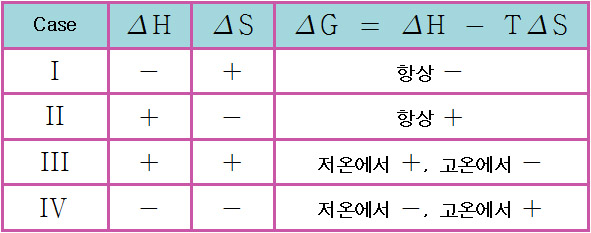
ΔH와 ΔS의 부호, 그리고 온도에 따라
ΔG의 부호가 위와 같이 결정된다는 것이 쉽게 이해되지 않으면,
다음과 같이 적당한 수치를
ΔG = ΔH – TΔS 식에 대입시켜 계산해보면 어떨까요?
① ΔH = +500
② ΔH = –500
③ ΔS = +2
④ ΔS = –2
⑤ T = 100 (저온)
⑥ T = 1000 (고온)
[I]의 경우, ②③에 해당되므로
②③⑤ 조합이면,
ΔG = (–500) – [100 × (+2)] = –700
②③⑥ 조합이면,
ΔG = (–500) – [1000 × (+2)] = –2500
ΔG는 항상 음수(–)이므로,
정반응은 모든 온도에서 자발적.
[II]의 경우, ①④에 해당되므로
①④⑤ 조합이면,
ΔG = (+500) – [100 × (–2)] = +700
①④⑥ 조합이면,
ΔG = (+500) – [1000 × (–2)] = +2500
ΔG는 항상 양수(+)이므로,
정반응은 모든 온도에서 비자발적.
[III]의 경우, ①③에 해당되므로
①③⑤ 조합이면,
ΔG = (+500) – [100 × (+2)] = +300
①③⑥ 조합이면,
ΔG = (+500) – [1000 × (+2)] = –1500
ΔG는 저온에서는 +, 고온에서는 –이므로,
정반응은 저온에서 비자발적, 고온에서 자발적.
[IV]의 경우, ②④에 해당되므로
②④⑤ 조합이면,
ΔG = (–500) – [100 × (–2)] = –300
②④⑥ 조합이면,
ΔG = (–500) – [1000 × (–2)] = +1500
ΔG는 저온에서는 –, 고온에서는 +이므로,
정반응은 저온에서 자발적, 고온에서 비자발적.
---------------------------------------------------
[1] ΔH < 0, ΔS > 0
> 발열 반응이므로, 에너지 측면에서 자발적.
> 엔트로피 증가이므로, 엔트로피 측면에서 자발적.
---> 모든 온도에서 자발적.
예) 2O3(g) → 3O2(g) ... ΔH = –426.9 kJ
( 참고: 발열 흡열 https://ywpop.tistory.com/5242 )
[2] ΔH > 0, ΔS < 0
> 흡열 반응이므로, 에너지 측면에서 비자발적.
> 엔트로피 감소이므로, 엔트로피 측면에서 비자발적.
---> 모든 온도에서 비자발적.
예) 3O2(g) → 2O3(g) ... ΔH = +284.6 kJ
[3] ΔH > 0, ΔS > 0
> 흡열 반응이므로, 에너지 측면에서 비자발적.
> 엔트로피 증가이므로, 엔트로피 측면에서 자발적.
> ΔG = ΔH – TΔS
---> 고온에서 자발적, 저온에서 비자발적.
예) H2O(s) → H2O(l) ... 물의 녹는점 이상 온도에서 자발적
[4] ΔH < 0, ΔS < 0
> 발열 반응이므로, 에너지 측면에서 자발적.
> 엔트로피 감소이므로, 엔트로피 측면에서 비자발적.
> ΔG = ΔH – TΔS
---> 저온에서 자발적, 고온에서 비자발적.
예) H2O(l) → H2O(s) ... 물의 어는점 이하 온도에서 자발적
---------------------------------------------------
폭포수가 위에서 아래로 떨어지는 것이 자연의 이치이듯이,
계의 에너지 준위는 높은 것보다는 낮은 것이
(자연의 이치에 따라) 보다 안정합니다.
계의 에너지 준위는
발열 과정에서 즉, 계의 엔탈피가 감소할 때, 낮아지고,
흡열 과정에서 즉, 계의 엔탈피가 증가할 때, 높아집니다.
이 때문에 계의 엔탈피가 감소하는 반응이 유리하다고 합니다.
절대영도(0 K) 이상에서는
모든 물질은 가만히 있지 않고 끊임없이 운동하기 때문에,
한곳에 일정하게 규칙적으로 질서 있게 모여 있지 않고,
혼란스럽게 여기저기 마구 돌아다닙니다.
즉, 규칙적인(질서를 갖춘) 것보다
무질서한 것이 자연의 이치입니다.
유치원생들이 선생님 통제 밖에 있으면,
각자 조용히 가만히 앉아 있기 보다는,
서로 장난치고, 떠들고, 여기저기 뛰어다니는 것이
더 자연스러운 현상입니다.
분자들도 유치원생들과 마찬가지입니다.
계의 무질서한 정도를 엔트로피로 나타낼 수 있는데,
계가 무질서할수록 계의 엔트로피는 증가하며,
계가 질서를 갖출수록 계의 엔트로피는 감소합니다.
이 때문에 계의 엔트로피가 증가하는 반응이 유리하다고 합니다.
[ 관련 글 https://ywpop.tistory.com/7438 ] Gibbs 자유 에너지
[ 관련 글 https://ywpop.tistory.com/9301 ] ΔG = ΔH – TΔS 식과 ΔS = ΔH / T 식의 혼동
[키워드] 자유 에너지와 온도 기준문서, 반응 온도와 자유 에너지 기준문서, ΔG의 부호 기준문서, 자유 에너지의 부호 기준문서, ΔG의 부호 사전, 자유 에너지의 부호 사전
'일반화학 > [19장] 화학 열역학' 카테고리의 다른 글
| Gibbs 자유 에너지 (Gibbs Free Energy) ★ (1) | 2017.07.01 |
|---|---|
| 화학 반응에서 엔트로피 변화 ★ (0) | 2017.06.25 |
| 표준 생성 자유 에너지와 표준 자유 에너지 변화 ★ (1) | 2017.06.22 |
| 열역학 함수 계산할 때, 절대온도를 사용하는 이유 (0) | 2015.12.14 |
| 비표준 상태에서의 자유에너지. ΔG = ΔG° + RTlnQ (0) | 2015.12.12 |
| 용해 과정에서 용액의 엔트로피 변화 (1) | 2015.10.24 |
| ΔG = –nFE. Cr2O7^2-(aq) + 3Sn^2+(aq) + 14H^+(aq) (0) | 2014.12.11 |
| 열역학 제3법칙과 절대엔트로피 ★ (0) | 2013.10.25 |

댓글