0.1 M CH3COOH 50 mL + 0.1 M NaOH. 당량점 pH
0.1 M CH3COOH(시료) 50 mL를
0.1 M NaOH(표준 용액)로 적정할 때,
중화점(당량점)에서의 pH를 구하시오.
---------------------------------------------------
▶ 참고: 약산-강염기 적정
[ https://ywpop.tistory.com/2736 ]
---------------------------------------------------
CH3COOH와 NaOH는 1 : 1 반응하므로,
NaOH 50 mL를 가하면,
시료인 약산은 표준 용액인 강염기에 의해 완전히 중화된다.

그러나 이때 생성된 염의 가수분해 반응 때문에,
용액은 중성이 되지 않는다.
( 참고: 가수분해 https://ywpop.tistory.com/5502 )
즉, 0.05 M CH3COONa 용액과 똑같이 거동한다.
가한 NaOH의 mol수 = (0.1 mol/L) × 0.050 L = 0.005 mol
가한 NaOH의 몰수만큼 CH3COONa가 생성되므로,
CH3COONa의 몰농도를 계산하면,
0.005 mol / 0.100 L = 0.05 M
CH3COONa의 가수분해로 생성되는 [OH^-]는 다음과 같이 구한다.

( 참고: Kw=Ka×Kb https://ywpop.tistory.com/2937 )
(0.05–x) ≒ 0.05 라 근사처리하면,
x = [5.6×10^(-10) × 0.05]^(1/2)
= 5.29×10^(-6) M = [OH^-]
pOH = –log[OH^-]
= –log(5.29×10^(-6)) = 5.28
pH = 14 – 5.28 = 8.72
---> 당량점에서의 pH
---------------------------------------------------
왜 당량점에서 0.05 M CH3COONa 용액처럼 행동(거동)하는가?
CH3COOH와 NaOH가 반응하면, CH3COONa가 생성되기 때문이다.
CH3COOH(aq) + NaOH(aq) → CH3COONa(aq) + H2O(l)
즉, 당량점에서 용액 중에는 CH3COONa와 H2O 밖에 없다.
균형 맞춘 반응식에서
CH3COOH와 NaOH와 CH3COONa의 계수가 같으므로,
CH3COOH (또는 NaOH) 1 mol이 반응하면,
CH3COONa 1 mol이 생성된다.
따라서 CH3COOH 0.005 mol이 반응했으므로,
CH3COONa 0.005 mol이 생성된다.
용액의 전체 부피가 100 mL이므로, CH3COONa의 몰농도는
0.005 mol / 0.100 L = 0.05 M이 된다.
[ 관련 예제 https://ywpop.tistory.com/10384 ] 0.100 M CH3COOH 100 mL를 0.100 M NaOH로 적정. 당량점 pH
[ 관련 예제 https://ywpop.tistory.com/12633 ] 0.025 M 벤조산 40.0 mL를 0.050 M NaOH로 적정. 당량점 pH
[ 관련 글 https://ywpop.tistory.com/4039 ] 약산-강염기 적정에서 당량점에서의 pH가 7보다 높은 이유
[키워드] 약산-강염기 중화적정 기준문서, 약산-강염기 적정 기준문서, 약산-강염기 당량점 기준문서, 약산-강염기 중화점 기준문서, CH3COOH + NaOH 적정 기준문서
'일반화학 > [17장] 수용액 평형의 다른 관점' 카테고리의 다른 글
| Ag2CrO4의 몰용해도 ★ (0) | 2015.04.08 |
|---|---|
| 난용성염의 용해도와 공통이온효과. CaF2 (1) | 2015.01.15 |
| 용해도곱(solubility product) 상수, Ksp ★ (1) | 2014.11.07 |
| 0.20 M NaHCO3 0.10 M Na2CO3 buffer pH (1) | 2014.11.06 |
| N2H4-N2H5Cl 완충 용액 (buffer system) (0) | 2014.10.20 |
| 산-염기 중화 적정 과정에서 용액의 pH 계산: 약염기-강산 적정 (3) | 2014.08.11 |
| 산-염기 중화 적정 과정에서 용액의 pH 계산: 약산-강염기 적정 ★ (2) | 2014.08.08 |
| 산-염기 중화 적정 과정에서 용액의 pH 계산: 강산-강염기 적정 ★ (8) | 2014.08.06 |

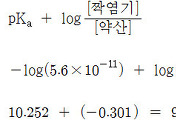

댓글