혼성 오비탈 (hybrid orbital)
---------------------------------------------------
▶ 참고: 파동 방정식과 오비탈
[ https://ywpop.tistory.com/7108 ]
---------------------------------------------------
▶ 혼성(混成)의 사전적 의미
> 서로 섞여서 이루어짐. 또는 섞어서 만듦.

> 혼성 오비탈은 color mixing과 비슷한 개념이다.
red와 green을 혼합하면, 새로운 yellow가 만들어지듯이,
s 오비탈과 p 오비탈을 혼합하면, 새로운 sp 오비탈이 만들어진다.
원자 오비탈의 혼성화 (hybridization)
▶ 한 원자 내의 서로 다른 오비탈들을 혼합하여, 새로운 오비탈을 만드는 것.
▶ 혼성 오비탈 (hybrid orbital)
> 혼성화를 통해 만들어진 새로운 오비탈.

왜 원자 내에서 원자 오비탈의 혼성화가 일어나서,
그 결과물인 혼성 오비탈이 만들어질까?
그 이유는 안정한 화합물이 되기 위해서, 또는
안정한 화합물을 만들기 위해서이다.
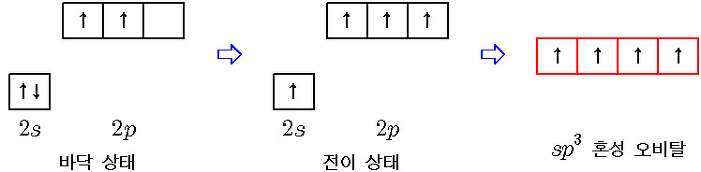
sp3 혼성 오비탈이 만들어지는 이유를 단계별로 살펴보자.

① 홀전자가 있는 탄소 원자의 2p 오비탈과
수소 원자의 1s 오비탈(역시 홀전자가 있는)이 겹치면,

⇨ 중심 원자인 탄소의 원자가전자 수 = 6
---> 옥텟 규칙에 위배.
( 참고: 옥텟 규칙 https://ywpop.tistory.com/2634 )
② 이와 같은 불안정한 상태를 해결하고자,
탄소 원자의 2s 전자들 중 하나가 2p 오비탈로 전이하면,

이 상태에선 탄소 원자에 홀전자가 4개 있기 때문에
CH4가 생성될 수 있고,
이때 탄소 원자의 원자가전자 수는 8이 되기 때문에
CH4는 안정하다고 생각될 것이다.
그러나 CH4는 여전히 불안정하다. Why?
첫째, 탄소 원자의 3개의 2p 오비탈 사이의 각도는 90°이고,
중심엔 2s 오비탈이 자리 잡고 있다.
이 상태에서 수소 원자의 1s 오비탈과 겹치면,
결합 전자쌍들끼리 반발이 너무 심하다.
90° 위치에 있는 3개의 [탄소 2p-수소 1s] 결합 전자쌍들끼리 반발도 심하지만,
그들 사이로 비집고 들어가 겹쳐 있는 [탄소 2s-수소 1s] 결합 전자쌍과
[탄소 2p-수소 1s] 결합 전자쌍들 사이의 반발은 너무 심하다.
둘째, 탄소 원자의 2s 오비탈과 2p 오비탈은
모양 및 에너지 준위가 서로 다르다.
⇨ 원자가 결합 이론에 따라,
4개의 C–H 결합은 결합 에너지 및 결합 길이가 달라야 한다.
⇨ 그러나 실험에 의하면,
4개의 C–H 결합은 결합 에너지 및 결합 길이가 모두 같다.
③ 그래서 원자 오비탈의 혼성화(hybridization)가 일어난다.
1개 s ← 모양 및 에너지 준위 서로 다름 → 3개 p
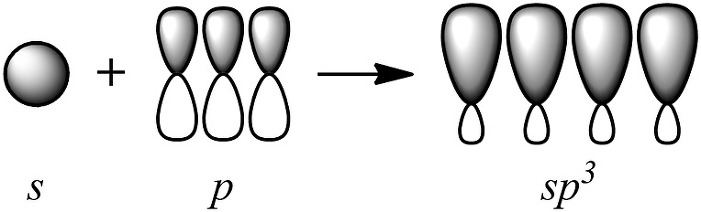
이제 막 원자 내에서 혼성 오비탈 4개가 새로이 만들어졌다.
그럼 이 4개 오비탈들은 원자 내에서 어떻게 자리를 차지할까?
VSEPR 모형 이론을 생각해보자.
VSEPR 모형 이론의 핵심은?
▶ 전자들은 서로 반발하기 때문에,
전자들은 가능한 한 서로 멀리 떨어지려고 한다.
⇨ 분자는 전자간 반발이 최소인 기하 구조를 갖는다.
( 참고: VSEPR 모형과 분자의 기하구조 https://ywpop.tistory.com/2571 )
원자 내에서 전자가 발견될 수 있는 확률을
양자역학으로 계산해서 그 결과를 (그림으로) 나타낸 것이
오비탈이기 때문에
( 필자는 오비탈을 전자가 거주하고 있는 방으로 비유한다. )
오비탈 역시 가능한 한 서로 멀리 떨어지려고 한다.
이 때문에 4개 오비탈은 탄소 원자를 중심으로
사면체 꼭짓점을 향해 자리를 잡는다.

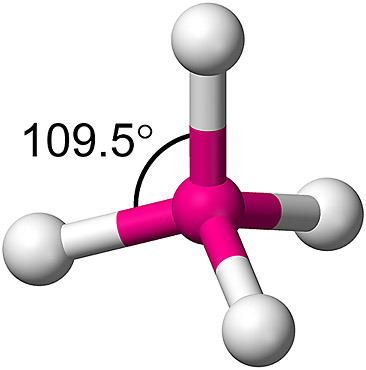
⇨ 4개의 C–H 결합은 결합 에너지 및 결합 길이가 모두 같다.
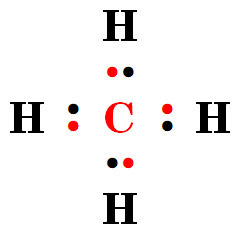
⇨ 안정한 CH4가 만들어진다.
---------------------------------------------------

여기서 질문 하나, 혼성에 사용된 원자 오비탈은 몇 개입니까?
답) ‘4개’입니다.
여기서 질문 둘, 새로 만들어진 혼성 오비탈은 몇 개입니까?
답) ‘4개’입니다.
⇨ 혼성에 사용된 재료(= 원자 오비탈)의 개수와
새로 만든 작품(= 혼성 오비탈)의 개수는 같다.

[ 관련 예제 https://ywpop.blogspot.com/2024/03/sp2.html ]
탄화수소의 혼성오비탈. sp2 혼성 오비탈로 결합하고 있는 물질은?

[ 관련 글 https://ywpop.tistory.com/2938 ] 탄소의 sp3, sp2, sp 혼성 오비탈. 산소의 sp3, sp2 혼성 오비탈. 질소의 sp2 혼성 오비탈.
N2, Cl2, CO, HF 등과 같은 이원자 분자도 혼성 오비탈을 가집니까?
Do diatomic molecules such as N2, Cl2, etc. or even CO, HF,
have hybridizations?
---------------------------------------------------
예. H2(수소 분자)를 제외한
( ∵ H 원자는 오로지 s 오비탈만 존재. )
모든 분자(이원자 분자 포함)는 혼성 오비탈을 가집니다.
N2, CO는 sp 혼성 오비탈을 가집니다.
O2는 sp2 혼성 오비탈을 가집니다.
Cl2 등 할로겐 기체들은 sp3 혼성 오비탈을 가집니다.
이원자 분자의 경우,
단일 결합이면, 대부분 sp3 혼성 오비탈을 가집니다.
이중 결합이면, sp2 혼성 오비탈,
삼중 결합이면, sp 혼성 오비탈을 가집니다.
Do diatomic molecules have hybridizations? You bet -- virtually all
(H2 is the only I can think of off the top of my head that does not).
N2 is sp-hybridized, as is CO.
O2 is sp2-hybridized.
Cl2 and the rest of the halogen gasses are sp3-hybridized.
Look for any diatomic molecules with single bonds;
they are sp3-hybridized, most likely.
Double bonds, sp2-hybridized, triple bonds, sp-hybridized.
---------------------------------------------------
▶ 혼성 오비탈 이론은 원자가 결합 이론(VBT)에 속한다.
( 참고 https://ywpop.tistory.com/9235 )
[ https://ywpop.tistory.com/16055 ] 탄소의 혼성 오비탈. CO2, 다이아몬드, 벤젠.
[ https://ywpop.tistory.com/15942 ] F2의 혼성 오비탈
[ https://ywpop.tistory.com/15730 ] Fe(CO)5의 dsp3 혼성 오비탈
[ https://ywpop.tistory.com/14805 ] PF5의 sp3d 혼성 오비탈
[ https://ywpop.tistory.com/11776 ] PF5의 sp3d 혼성 오비탈
[ https://ywpop.tistory.com/6013 ] PCl5의 sp3d 혼성 오비탈
[ https://ywpop.tistory.com/14630 ] SiCl4의 sp3 혼성 오비탈
[ https://ywpop.tistory.com/14612 ] XeF4의 sp3d2 혼성 오비탈
[ https://ywpop.tistory.com/9952 ] 질소의 혼성 오비탈. NH3, pyridine, pyrrole.
[ https://ywpop.tistory.com/9383 ] BeH2의 sp 혼성 오비탈
[ https://ywpop.tistory.com/7476 ] SF6의 sp3d2 혼성 오비탈
[ https://ywpop.tistory.com/7475 ] SF4의 sp3d 혼성 오비탈
[ 관련 글 https://ywpop.tistory.com/10807 ]
sp3 sp2 sp. s 오비탈의 비율
[키워드] 혼성 오비탈 기준, 혼성 오비탈 사전
'일반화학 > [09장] 분자의 기하구조와 결합 이론' 카테고리의 다른 글
| 탄소(carbon), 산소(oxygen)의 혼성 오비탈(hybrid orbital) (6) | 2014.10.30 |
|---|---|
| 분자 오비탈 전자 배치, 질소 분자(N2), 이온 (0) | 2014.10.22 |
| 분자 오비탈 전자 배치. 산소 분자(O2), 이온(O2^2-) (0) | 2014.10.21 |
| NO2 NO2^+ NO2^- NO NO^-의 루이스 구조식 ★ (5) | 2014.09.29 |
| 원자가 결합 이론. Valence Bond Theory, VBT (3) | 2014.06.27 |
| Sulfur Tetrafluoride(SF4) 분자의 Seesaw Molecular Geometry 설명 (0) | 2014.05.30 |
| 원자가 껍질 전자쌍 반발 모형으로 분자의 기하 구조 예측 (3) (0) | 2014.05.29 |
| 원자가 껍질 전자쌍 반발 모형으로 분자의 기하 구조 예측 (2) (0) | 2014.05.29 |






댓글