팔전자 규칙. 옥텟 규칙. octet rule
화학 결합의 기본 개념
---------------------------------------------------
▶ 참고: 제8장 화학 결합의 기본 개념. 목차
[ https://ywpop.tistory.com/15249 ]
---------------------------------------------------

화학 결합의 기본 개념
Basic Concepts of Chemical Bonding
▶ 원자들이 서로 결합하여 분자가 되는 이유?

▶ 원자들이 서로 결합하여 분자가 되는 이유
> 결합하면 더 안정해지기 때문.

사람도 비슷하다,
결혼하면 정신적이든, 물질적이든 더 안정해지기 때문에
결혼한다고 볼 수 있다.

8A족, 영족 기체(비활성 기체)는
원자 그 자체로 매우 안정하다.
> 다른 원자와 결합할 이유가 없다.
( 참고: 8A족 = 18족 https://ywpop.tistory.com/5893 )

사람도 비슷하다,
아주 능력 있는 사람은
늦게 결혼하거나, 아예 혼자 산다.

▶ 원자의 이상형은 비활성 기체,
or 비활성 기체의 원자가 전자(valence electron, VE) 배열.
▶ 자신의 전자 배열이
비활성 기체의 원자가 전자 배열과 같아진다면,
원자는 기꺼이 다른 원자와 결합하여 분자가 되려한다.
---> 화학 결합의 기본 개념
원자는 주기율표상에서 자신과 가장 가까이에 있는
비활성 기체 원자의 원자가 전자 배열과 같아지도록 (또는 같아지기 위해)
전자를 잃거나 얻는다.
---> 금속 원소는 전자를 잃고 양이온이 되기 쉽고,
비금속 원소는 전자를 얻어 음이온이 되기 쉬운 이유

예를 들면,
칼륨(K)은 아르곤(Ar)과 같아지려고 전자 1개를 잃고, +1가 양이온이 되고,
산소(O)는 네온(Ne)과 같아지려고 전자 2개를 얻어, –2가 음이온이 된다.
[ 관련 글 https://ywpop.tistory.com/15348 ] 금속은 산화, 비금속은 환원되기 쉬운 이유
나트륨(Na)은 네온(Ne)과 같아지려고 전자 1개를 잃고, +1가 양이온이 된다.
Na의 VE = 1개, Ne의 VE = 8개 = Na^+의 VE
염소(Cl)는 아르곤(Ar)과 같아지려고 전자 1개를 얻고, –1가 음이온이 된다.
Cl의 VE = 7개, Ar의 VE = 8개 = Cl^-의 VE
마그네슘(Mg)은 네온(Ne)과 같아지려고 전자 2개를 잃고, +2가 양이온이 된다.
Mg의 VE = 2개, Ne의 VE = 8개 = Mg^2+의 VE
산소(O)는 네온(Ne)과 같아지려고 전자 2개를 얻고, –2가 음이온이 된다.
O의 VE = 6개, Ne의 VE = 8개 = O^2-의 VE
알루미늄(Al)은 네온(Ne)과 같아지려고 전자 3개를 잃고, +3가 양이온이 된다.
Al의 VE = 3개, Ne의 VE = 8개 = Al^3+의 VE
▶ 최외각 전자가 8개이면, 안정한 이유?
최외각 전자가 8개이면, 안정하다고 생각하는 이유?
---------------------------------------------------
① 비활성기체족 원소들은 자연계에서 원자 상태로 존재한다. 즉,
비활성기체족 원소들은 거의 대부분 다른 원소와 화학 반응하지 않는다.
---> 화학 반응하지 않는다. = 화학적으로 매우 안정하다.
> 이미 설명했듯이, 자연 상태에서 원자는 불안정하기 때문에,
물질은 원자가 아닌 분자로 존재한다.
> 이 때문에, 분자를 특정한(고유한) 성질을 갖는
가장 작은 물질이라고도 정의한다.
> 비활성기체족은 원자 그 자체로 안정하기 때문에,
자연계에서 원자 상태로 존재할 수 있다.
> 비활성기체족은, 원자이지만, 고유한 성질을 갖기 때문에,
분자에 포함시킨다. 그래서 ‘단원자분자’라고 부른다.
( 참고 https://ywpop.tistory.com/2984 )
② 비활성기체족 원소들은 최외각 전자가 8개이다.
---> 아~, 최외각 전자가 8개이면, 화학적으로 안정하구나...
( 인간들이 과학적 사고와 관찰을 통해 얻은 결론 )
[ 관련 글 https://ywpop.tistory.com/15174 ] 비활성 기체의 전자 배치는 왜 안정하다고 하는가?
옥텟 규칙은
원자들이 화학 결합해서 화합물이 될 때,
왜 어떤 원자는 전자를 잃으려고 하는가?
왜 어떤 원자는 전자를 얻으려고 하는가?
왜 어떤 원자는 전자를 공유하려 하는가?
에 대한 이유를 설명하는 이론이다.
팔전자 규칙. 옥텟 규칙
자신과 가장 가까운 비활성 기체(noble gas)와
똑같은 원자가 전자 배치(원자가 전자 수 = 8)를 갖기 위하여,
전자를 잃거나 얻거나 혹은 공유하려는 원자들의 경향성.
⇨ 원자들은 8개의 원자가 전자를 가지려고, 전자를 얻거나 잃거나 혹은 공유한다.
⇨ 원자들은 자신의 s와 p 부껍질에 전자를 다 채우려고 한다.
⇨ 예외: d와 f 부껍질을 갖는 원자.
⇨ 예외: 수소(H)는 헬륨(He)의 원자가 전자 수와 같은 2개를 가지려고 한다.
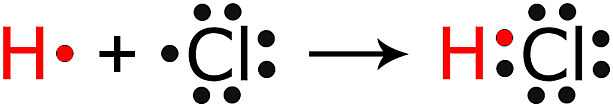
수소(H) 원자의 1개 원자가 전자와 염소(Cl) 원자의 1개 원자가 전자 공유
⇨ H의 원자가 전자 = 2개 (= He의 원자가 전자)
⇨ Cl의 원자가 전자 = 8개 (= Ar의 원자가 전자)
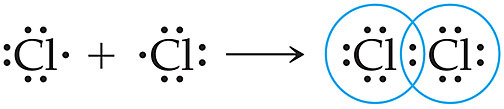
[참고] 모든 원자, 분자가 옥텟 규칙을 따르지는 않는다.
옥텟 규칙 예외. 모든 원자가 옥텟 규칙을 따르지는 않는다. 소수의 일부 원자만 옥텟 규칙을 따른다.
( 참고 https://ywpop.tistory.com/5627 )
[ 관련 글 https://ywpop.tistory.com/24061 ] NaCl octet rule
[ 관련 글 https://ywpop.tistory.com/8577 ] 옥텟 규칙의 예외
[키워드] 팔전자 규칙 기준문서, 옥텟 규칙 기준문서, 옥텟 룰 기준문서, 팔전자 기준문서, 옥텟 기준문서, 화학결합의 원리 기준문서, 원자의 이상형 기준문서, 팔전자 규칙 사전, 옥텟 규칙 사전, 옥텟 룰 사전, 팔전자 사전, 옥텟 사전, 화학결합의 원리 사전, 원자의 이상형 사전
'일반화학 > [08장] 화학결합의 기본 개념' 카테고리의 다른 글
| 3가지 화학 결합 ★ (1) | 2014.11.29 |
|---|---|
| NH4^+는 극성 분자인가? 쌍극자모멘트 값은? (1) | 2014.11.04 |
| 루이스 전자 점 기호로 나타낸 주기율표 (1) | 2014.10.13 |
| 공명 구조. resonance structures ★ (0) | 2014.06.26 |
| 일산화탄소(carbon monoxide, CO)의 작은 쌍극자 모멘트(dipole moment) (1) | 2014.06.25 |
| 쌍극자(dipole), 쌍극자모멘트(dipole moment), 분자의 극성 ★ (1) | 2014.06.03 |
| 전기음성도 (electronegativity) ★ (0) | 2014.05.26 |
| 공유 결합의 종류, 분류 (0) | 2014.05.25 |




댓글