NO2 NO2^+ NO2^- NO NO^-의 루이스 구조식
[1] NO2의 루이스 구조식. Lewis structure of NO2 (nitrogen dioxide)
① (최소) 형식 전하 규칙
( 참고: 형식 전하 https://ywpop.tistory.com/2544 )


> O의 형식전하 = 6 – 4 – (4/2) = 0
> N의 형식전하 = 5 – 1 – (8/2) = 0
( 양쪽 산소의 형식전하=0, 질소의 형식전하=0 )
( 참고: NO2 루이스 구조 그리기 https://ywpop.tistory.com/10314 )
---> ①번 구조는 형식 전하가 존재하지 않기 때문에,
형식 전하만을 고려하면 아래 ②번 구조보다 더 안정한 구조이다. 그러나...
N은 2주기 원소이므로 옥텟(8전자)을 초과할 수 없다.
( ①번 구조에서 N은 옥텟을 초과한 9개의 주위 전자를 가진다. )
② 옥텟 규칙 ( N은 2주기 원소이므로 옥텟을 초과할 수 없으므로... )

> O(왼쪽)의 형식전하 = 6 – 4 – (4/2) = 0
> N의 형식전하 = 5 – 1 – (6/2) = +1
> O(오른쪽)의 형식전하 = 6 – 6 – (2/2) = –1
( 왼쪽 산소의 형식전하=0, 질소의 형식전하=+1, 오른쪽 산소의 형식전하=–1 )
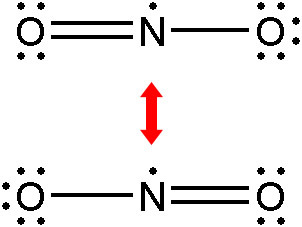
[그림] NO2의 공명 구조.
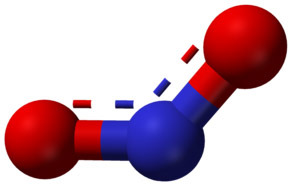
[그림] NO2의 분자 구조. ( 출처: wikimedia )
[동영상] 3D structure of NO2.
②번 구조는, 비록 형식 전하가 존재하지만, 공명 구조를 갖기 때문에,
즉, 형식 전자로 인한 불안정성보다
공명 구조로 인한 안정성이 훨씬 더 크기 때문에,
NO2의 실제 구조는 공명 구조를 갖는 ②번 구조이다.
---------------------------------------------------
[2] NO2^+의 루이스 구조식
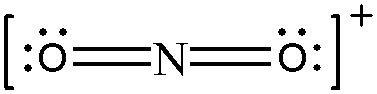
> N의 형식전하 = 5 – 0 – (8/2) = +1
> O의 형식전하 = 6 – 4 – (4/2) = 0
( 양쪽 산소의 형식전하=0, 질소의 형식전하=+1 )

[그림] Resonance structures for NO2^+.
---------------------------------------------------
[3] NO2^-의 루이스 구조식
2개의 공명 구조

> O(왼쪽)의 형식전하 = 6 – 4 – (4/2) = 0
> N의 형식전하 = 5 – 2 – (6/2) = 0
> O(오른쪽)의 형식전하 = 6 – 6 – (2/2) = –1
( 왼쪽 산소의 형식전하=0, 질소의 형식전하=0, 오른쪽 산소의 형식전하=–1 )
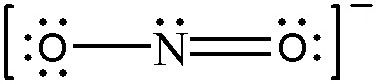
( 왼쪽 산소의 형식전하=–1, 질소의 형식전하=0, 오른쪽 산소의 형식전하=0 )
---------------------------------------------------
[참고] O–N–O bond angle: NO2^+, NO2, NO2^-

▶ NO2^+의 결합각 = 180°
---> 중심원자 N에 비공유전자 없음.
---> 중심원자 N의 전자 영역 = 2
( 참고: 전자 영역 https://ywpop.tistory.com/2569 )
---> 전자의 기하구조: 직선형 (linear)
---> 분자의 기하구조: 직선형 (linear)
▶ NO2의 결합각 = 134°
---> 중심원자 N에 비공유전자 1개 존재.
---> 중심원자 N의 전자 영역 = 3
---> 전자의 기하구조: 삼각평면 (trigonal planar)
---> 분자의 기하구조: 굽은형 (bent)
▶ NO2^-의 결합각 = 115°
---> 중심원자 N에 비공유전자 2개 존재.
( 비공유전자 1개보다 2개가 차지하는 공간이 더 넓어서 반발력이 더 크다. )
---> 중심원자 N의 전자 영역 = 3
---> 전자의 기하구조: 삼각평면 (trigonal planar)
---> 분자의 기하구조: 굽은형 (bent)
[ 관련 글 https://www.quora.com/What-will-the-hybridisation-of-NO2 ]
[ 관련 글 https://ywpop.tistory.com/15733 ] 전자의 기하구조와 분자의 기하구조
---------------------------------------------------
[4] NO의 루이스 구조식. Lewis structure of NO (nitrogen monoxide)
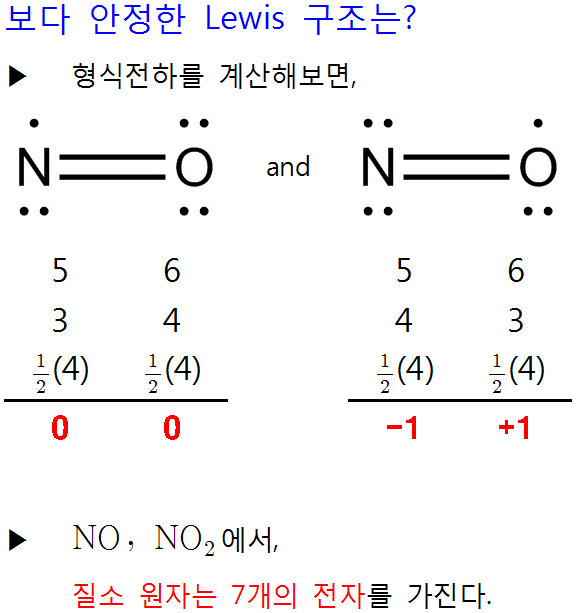
[ 관련 글 https://ywpop.tistory.com/10503 ] NO 루이스 구조 그리기
---------------------------------------------------
[5] NO^-의 루이스 구조식. Lewis structure of NO^- (nitroxyl anion)
5 + 6 + 1 = 12
N–O
12 – 2 = 10
N–O(6)
10 – 6 = 4
N(4)–O(6)
N(4)=O(4)
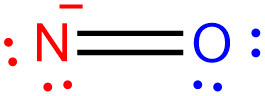
> N의 형식전하 = 5 – 4 – (4/2) = –1
> O의 형식전하 = 6 – 4 – (4/2) = 0
[ 관련 글 https://ywpop.tistory.com/11551 ] NO^+의 루이스 구조식
[키워드] 옥텟 규칙 예외 기준, 옥텟 예외, 팔전자 규칙 예외 기준, 옥텟 룰 예외 기준, 이산화질소 루이스 기준, NO2 루이스 기준, 일산화질소 루이스 기준, NO 루이스 기준, NO^- 루이스 기준, 일산화질소 이온 루이스 기준, 일산화질소 이온 루이스 구조 기준, 일산화질소 이온 루이스 사전, 일산화질소 이온 루이스 구조 사전, 이산화질소 이온 루이스 기준, 이산화질소 이온 루이스 구조 기준, 이산화질소 이온 루이스 사전, 이산화질소 이온 루이스 구조 사전, 일산화질소 루이스 기준, 일산화질소 루이스 구조 기준, 일산화질소 루이스 사전, 일산화질소 루이스 구조 사전, 이산화질소 루이스 기준, 이산화질소 루이스 구조 기준, 이산화질소 루이스 사전, 이산화질소 루이스 구조 사전
[구글 리포트] 2021년 12월 인기 상승 페이지
'일반화학 > [09장] 분자의 기하구조와 결합 이론' 카테고리의 다른 글
| Lewis dot structure of H3PO4 (phosphoric acid) (0) | 2014.11.20 |
|---|---|
| 탄소(carbon), 산소(oxygen)의 혼성 오비탈(hybrid orbital) (6) | 2014.10.30 |
| 분자 오비탈 전자 배치, 질소 분자(N2), 이온 (0) | 2014.10.22 |
| 분자 오비탈 전자 배치. 산소 분자(O2), 이온(O2^2-) (0) | 2014.10.21 |
| 혼성 오비탈 (hybrid orbital) ★ (9) | 2014.06.27 |
| 원자가 결합 이론. Valence Bond Theory, VBT (3) | 2014.06.27 |
| Sulfur Tetrafluoride(SF4) 분자의 Seesaw Molecular Geometry 설명 (0) | 2014.05.30 |
| 원자가 껍질 전자쌍 반발 모형으로 분자의 기하 구조 예측 (3) (0) | 2014.05.29 |




댓글