Sulfur Tetrafluoride(SF4) 분자의 Seesaw Molecular Geometry 설명
[참고] SF4 루이스 구조 그리기. Lewis structure of SF4
[ https://ywpop.tistory.com/9976 ]
Sulfur Tetrafluoride (사플루오린화 황) 분자의 중심 원자는 황(S)이고,
황의 전자 영역은 5개(결합전자쌍 4개 + 비결합전자쌍 1개)이므로,
Sulfur Tetrafluoride 분자의 전자 영역의 기하 구조는
삼각이중피라미드(Trigonal Bipyramidal)이다.
( 참고: 전자영역의 기하구조 https://ywpop.tistory.com/11542 )

[그림] Trigonal Bipyramidal.
중심 원자가 sp^3d 혼성 오비탈이므로,
( 참고 https://ywpop.tistory.com/7475 )
전자 영역의 기하 구조는 trigonal bipyramidal.
그러나 황 원자에 존재하는 비결합전자쌍 1개 때문에,
Sulfur Tetrafluoride 분자의 기하 구조는
삼각이중피라미드 구조가 아닐 것으로 예측된다.
황 원자의 5개 전자 영역 중에서,
비결합전자쌍 1개는 어느 곳에 위치할까?
비결합전자쌍(Lone pair)과
90° 위치에서 반발하는 결합전자쌍만 체크해 보자.
(∵ 120° 정도 떨어져 있는 전자쌍 간 반발력은
90° 위치에 비해 상대적으로 약하기 때문에 무시하자.)

> Lone pair가 축 위치에 있을 경우, 반발 가능한 전자쌍은 3개.
> Lone pair가 평면 위치에 있을 경우, 반발 가능한 전자쌍은 2개.
∴ Lone pair가 평면 위치에 있을 경우,
전자쌍 간 반발이 최소가 된다.
---> SF4 분자의 기하 구조는 시소형.


[그림] SF4 분자의 기하 구조는 시소형 (seesaw shape).
▶ red S–F 결합전자쌍은 비결합전자쌍과 90° 위치에서 강하게 반발한다.
---> red S–F 결합전자쌍은 비결합전자쌍에서 최대한 멀리 떨어져 있으려 한다.
---> 이 때문에, F–S–F 결합각과 S–F 결합길이, 둘 다 증가한다.
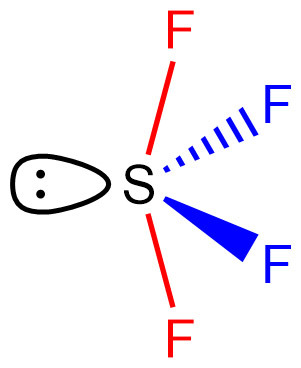
> red S–F bond length = 164.6 pm
> blue S–F bond length = 154.5 pm

▶ SF4는 극성 분자. SF4 is polar.
( 참고 https://www.quora.com/Is-SF4-consided-polar-or-nonpolar )
[ 관련 글 https://ywpop.tistory.com/2576 ]
ClF3 분자의 T-shaped Molecular Geometry 설명
[키워드] SF4 기준, SF4 루이스 기준, SF4 기하구조 기준, SF4 polar or nonpolar, SeF4 기준, SeF4 루이스 기준, SeF4 기하구조 기준, SeF4 polar or nonpolar, VSEPR 기준, 90도 반발 기준, ClF3 기준, ClF3 루이스 기준, ClF3 기하구조 기준
'일반화학 > [09장] 분자의 기하구조와 결합 이론' 카테고리의 다른 글
| 분자 오비탈 전자 배치. 산소 분자(O2), 이온(O2^2-) (0) | 2014.10.21 |
|---|---|
| NO2 NO2^+ NO2^- NO NO^-의 루이스 구조식 ★ (5) | 2014.09.29 |
| 혼성 오비탈 (hybrid orbital) ★ (9) | 2014.06.27 |
| 원자가 결합 이론. Valence Bond Theory, VBT (3) | 2014.06.27 |
| 원자가 껍질 전자쌍 반발 모형으로 분자의 기하 구조 예측 (3) (0) | 2014.05.29 |
| 원자가 껍질 전자쌍 반발 모형으로 분자의 기하 구조 예측 (2) (0) | 2014.05.29 |
| 원자가 껍질 전자쌍 반발 모형으로 분자의 기하 구조 예측 (1) (2) | 2014.05.28 |
| 분자의 기하 구조와 원자가 껍질 전자쌍 반발 모형 (VSEPR model) (2) | 2014.05.27 |




댓글