파동방정식과 오비탈
---------------------------------------------------
▶ 참고: 제6장 원자의 전자 구조. 목차
[ https://ywpop.tistory.com/15222 ]
---------------------------------------------------

> 슈뢰딩거(Schrödinger): 양자는 파동성과 입자성, 둘 다 가진다.
> 양자란? 양자의 정의 [ https://ywpop.tistory.com/2923 ]

▶ 아이디어 제공자들
> 하이젠베르크(Heisenberg)와 [ https://ywpop.tistory.com/7186 ]
드브로이(de Broglie) [ https://ywpop.tistory.com/3539 ].

> 슈뢰딩거의 파동방정식 자체는
모든 양자(미시계)의 운동과 에너지를 해석할 수 있는 도구(tool)이다,
마치 뉴턴역학이 모든 거시계의 운동과 에너지를 해석할 수 있는 도구이듯이.
> 슈뢰딩거의 파동방정식(수학 함수)을 사용해서
원자 내 전자의 위치를 확률적으로 계산해낸 결과물이 바로 오비탈이다.

> “그림으로 나타낸 것이 오비탈”이라 설명한 이유는
일반 교재에서는, 학생들의 이해를 돕기 위해,
오비탈을 그림으로 그려 설명하고 있기 때문이다.
> 그러나 “오비탈 = 파동방정식의 해”로, 수학으로 계산한 결과물이다.
즉, 양자역학 교재에서 오비탈은 어지러운(?) 숫자와 기호일 뿐이다.

> 원자 아파트의 입주민, 전자
> n=1 → 1층, n=2 → 2층, n=3 → 3층
> 101호 → 1s 오비탈
> 201호 → 2s 오비탈
> 211호 → 2p_x 오비탈
> 212호 → 2p_y 오비탈
> 213호 → 2p_z 오비탈
> 301호 → 3s 오비탈
> 311호, 312호, 313호 → 3개의 3p 오비탈
> 321호, 322호, 323호, 324호, 325호 → 5개의 3d 오비탈
> 1번째 전자껍질에 있는 전자 = 1층에 사는 주민
> 2번째 전자껍질에 있는 전자 = 2층에 사는 주민
> 2번째 전자껍질에서 운동하는 전자가 1번째 전자껍질에서도 발견되는 이유
---> 2층에 사는 주민이 잠시 1층에 사는 친구 집에 놀러갔다 들킨(?) 경우


[ 그림 출처 opentextbc.ca ] 3개의 p 오비탈.
(a) p_x 오비탈, (b) p_y 오비탈, (c) p_z 오비탈.

[ 그림 출처 Wikimedia ] 5개의 d 오비탈.

[ 그림 출처 Wikimedia ] 7개의 f 오비탈.

> 1913년, 보어.
> 전자들은 원자핵 주위의 일정한 궤도를 따라 원운동을 하며,
각 궤도는 불연속적으로 띄엄띄엄 떨어져 있다고 설명.
> 이때 보어가 설명한 궤도가 바로 궤도(orbit).

> 그러나 양자역학과 통계역학을 동원하여 원자 내부를 좀 더 자세히 들여다보니,
원자 내에 있는 전자들의 정확한 위치는 알 수가 없기 때문에
( 따라서 보어 설명처럼 전자 궤도로 나타낼 수 없다 ),
단지 어느 공간에서 발견할 수 있는 확률(확률 함수)로만
전자들을 나타낼 수 있다는 것을 알게 되었다.
> 이 확률을 파동방정식으로 계산해서 (그림으로) 나타낸 것이 바로 궤도함수(orbital).

[참고] 재미있는(흥미로운) 점은
궤도함수(오비탈)에서 전자를 발견할 수 있는 확률이 가장 높은 지점은
보어의 궤도와 비슷하다는 것이다.
이 때문에 전자의 전이를 “간단히” 설명할 때는
개념이 “간단한” 보어의 궤도로 설명하는 것이다.
[추가 설명] 궤도 = orbit = 껍질 이고, (보어 설명)
궤도함수 = orbital (오비탈) 인데, (현대 양자역학 설명)
전자가 발견되는 확률이 매우 높은 지점은 보어가 설명한 궤도 근처이므로,
즉, 대부분의 전자는 보어가 설명한 궤도 근처에서 발견되므로,
오비탈 ≒ 껍질 이라 간주해도 됩니다.
단, 차이점은
궤도로 나타낸 껍질은 (궤도의 크기에 상관없이) 1개 궤도당 1개 껍질뿐이지만,
오비탈로 나타낸 껍질은 1개 오비탈당 여러 개 껍질(sub-shell)로
이루어져 있다는 것입니다. (단, 수소, 헬륨은 예외.)
s-오비탈, p-오비탈, d-오비탈... 이 바로 sub-shell입니다.
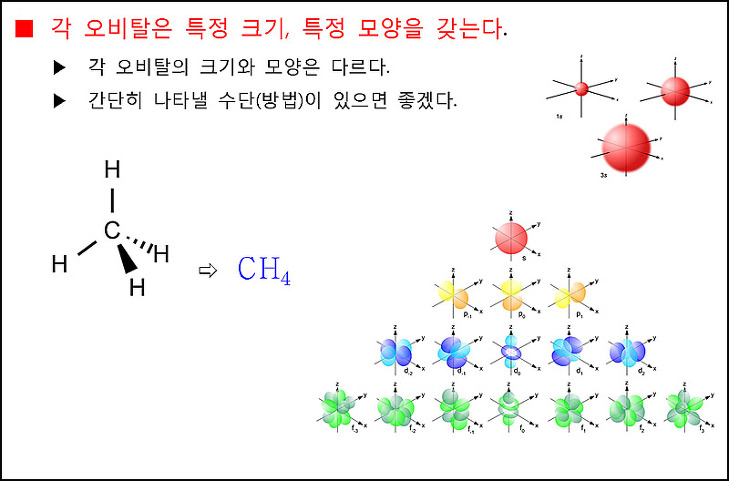
> 간단히 나타낼 수단(방법)이 있으면 좋겠다.
마치 메테인을 CH4로 간단히 나타내듯이...

> 어떤 화합물을 원소기호와 숫자를 사용해서 간단히 나타낼 수 있듯이,
( 우리는 이것을 ‘화학식’이라하며, 예를 들어, 이산화탄소는 간단히 ‘CO2’로 나타낼 수 있다. )
크기와 모양이 다양한 오비탈을 일일이 그림으로 그려서 나타내는 대신,
숫자와 기호로 간단히 나타내고 싶었다. 누가? 과학자들이...
그래서 만든 개념이 양자수이다.
> CO2를 보면, 이것이 이산화탄소라는 것을 알 수 있듯이,
3p^5를 보면, 3번째 껍질의 p 오비탈에 전자가 5개 있다는 것을 알 수 있다.
[ 이어지는 글 https://ywpop.tistory.com/2932 ] 한 벌의 양자수, a set of quantum numbers.
[키워드] 오비탈 기준, 오비탈의 정의 기준, 궤도함수 기준, 양자수의 정의 기준, 양자역학 기준, 원자 아파트 기준, 전자의 주민등록번호 기준, 파동 방정식 기준, 파동방정식 기준, d 오비탈 모양 기준, f 오비탈 모양 기준, 오비탈 사전, 오비탈의 정의 사전, 궤도함수 사전, 양자수의 정의 사전, 양자역학 사전, 원자 아파트 사전, 전자의 주민등록번호 사전, 파동 방정식 사전, 파동방정식 사전, d 오비탈 모양 사전, f 오비탈 모양 사전, 오비탈 = 방 기준, 오비탈 = 방 사전
---------------------------------------------------
[재미있는(?) 과학사 이야기]
▶ 드브로이가 자신의 지도교수인 랑자방에게 박사학위 논문 제출.
( 참고: 드브로이는 현대 과학자 중 가장 높은 귀족인 공작 )
▶ 랑자방: 도대체 뭔 얘기야? 하나도 이해할 수 없군.
공작이라서 무시할 수도 없고...
어? 가만... 광량자설이 나오네...
친구인 아인슈타인에게 심사를 의뢰해야겠다.
▶ 아인슈타인: 알쏭달쏭?!?, 하지만 재미있군.
지인인 슈뢰딩거에게 한 번 보여줘야겠다.
▶ 슈뢰딩거: “전자는 파동임에 틀림없다.”
고전역학에서 양자(= 전자)는 파동이라고 생각했다.
이걸 아인슈타인이 광전효과로 전자는 입자임을 증명했다.
( 이로서 플랑크의 E = nhν, 즉 빛의 불연속성 설명 )
( 관련 글 https://ywpop.tistory.com/13198 )
이걸 드브로이가, 그것도 박사과정 학생 신분으로,
전자는 파동임을 주장한 것이다.
이랬으니, 대학자인 랑자방과 아인슈타인 조차도
드브로이의 논문을 이해하지 못했던 것이다.
나중에 X-선 회절 실험을 통해 전자는 파동임이 입증되었다.
( 참고 https://ywpop.blogspot.com/2024/01/x-diffraction.html )
'일반화학 > [06장] 원자의 전자 구조' 카테고리의 다른 글
| 빛의 에너지와 진동수, 파장 관계(예제) (2) | 2017.05.22 |
|---|---|
| 오비탈의 종류와 개수 (0) | 2017.05.18 |
| 파동. 파장. 진동수 ★ (0) | 2017.05.16 |
| 회전하는 전자는 왜 빛을 방출하지 않는가? (0) | 2017.05.15 |
| 수소 원자의 에너지 준위 차이 ★ (2) | 2017.04.29 |
| 다전자원자 오비탈의 에너지 준위. (n+l) 규칙 (0) | 2017.04.06 |
| 전자기 복사선의 일반적인 파장 단위 (0) | 2017.03.23 |
| 수소 원자 오비탈의 에너지 준위 간격과 거리 간격 (1) | 2017.03.20 |




댓글